3 M KCl 용액 1 L 제조에 필요한 KCl의 질량
---------------------------------------------------
KCl의 몰질량 = 74.55 g/mol
( 참고 https://ywpop.tistory.com/18326 )
M × V = n 이고,
(mol/L) (L) = mol
( 참고 https://ywpop.tistory.com/7787 )
n × M = W 이므로,
(mol) (g/mol) = g
( 참고 https://ywpop.tistory.com/7738 )
(3 mol/L) (1 L) (74.55 g/mol) = 223.65 g KCl
[공식] 용액 제조에 필요한 용질의 질량(g)
= 몰농도 × 부피(L) × 몰질량 / (순도/100)
= 3 × 1 × 74.55 = 223.65 g
※ 시약의 순도가 주어지지 않았다면, (순도/100) 생략.
[ 용액 제조 방법 ]
1) 제조하려는 용액의 부피에 해당하는 부피 플라스크에다가
위에서 계산한 질량만큼의 KCl을 넣는다.
2) 제조하려는 용액의 부피의 대략 1/2에 해당하는 증류수를 가해
KCl을 완전히 용해시킨다.
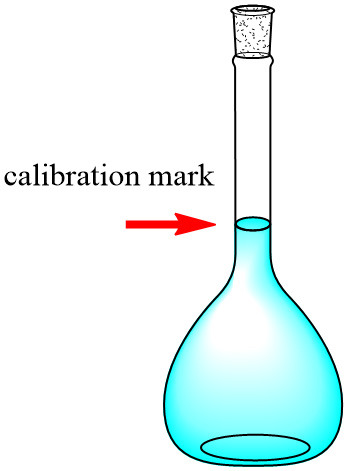
3) 부피 플라스크의 표선(calibration mark)까지 증류수를 마저 채운다. 끝.
( 참고 https://ywpop.tistory.com/7615 )
[키워드] KCl 몰농도 기준문서, KCl 몰농도 사전, KCl 용액 기준문서, KCl 용액 사전, 염화칼륨 몰농도 기준문서, 염화칼륨 몰농도 사전, 염화칼륨 용액 기준문서, 염화칼륨 용액 사전
'화학 > 용액의 농도' 카테고리의 다른 글
| H2O 75.0 g에 NaCl 4.5 g을 녹여 만든 용액 (0) | 2021.06.21 |
|---|---|
| 몰농도와 노르말농도. Ca(OH)2 5.21 mg 1000. mL (1) | 2021.06.19 |
| 19.4 M NaOH 50% 3.00 M NaOH 3.50 L (2) | 2021.06.18 |
| 35% 포르말린 용액 160 μL 안의 포르말린 질량(mg) (0) | 2021.06.17 |
| 35% 염산 시약으로 1 N HCl 용액 1000 mL 만들기 (0) | 2021.06.17 |
| 식초 내 아세트산 정량. 0.1 N (f = 1.0104) NaOH 13.7916 mL 소비 (0) | 2021.06.16 |
| 2.50 M 포도당 용액 8.40 mL를 32.0 mL로 (0) | 2021.06.16 |
| 25.00 mL HCl 2.000 M NaOH 3.17 mL 42.71 mL (0) | 2021.06.15 |
댓글