탄소 양이온과 탄소 음이온
Carbocation or Carbonium ion
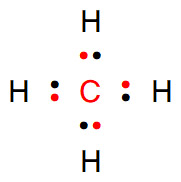
[그림] CH4의 루이스 구조.

중성인 CH4 분자에서,
H–CH3
H 원자가 떨어져 나갈 때,
[참고] 간단히 나타내기 위해 H 원자를 예로 표기했지만,
H 원자 대신 다른 원자(단) (이탈기, leaving group)도 가능하다.
1) 결합전자쌍을 중심원자인 C에게 주고 간다.
H–CH3 → –:CH3 + H^+
▶ 탄소의 주위 전자 수 = 8개
▶ 탄소의 전자 수 = 5개
---> 탄소의 원자가전자 수보다 1개 많기 때문에, C^–
▶ 탄소 음이온의 형식전하 = 4 – 2 – (6/2) = –1
형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
2) 결합전자쌍을 H가 갖고 간다.
H–CH3 → +CH3 + :H^–
▶ 탄소의 주위 전자 수 = 6개
▶ 탄소의 전자 수 = 3개
---> 탄소의 원자가전자 수보다 1개 적기 때문에, C^+
▶ 탄소 양이온의 형식전하 = 4 – 0 – (6/2) = +1
[ 관련 글 https://ywpop.tistory.com/23324 ] 탄소 이온의 이온식
[ 관련 글 https://ywpop.tistory.com/2704 ]
공유 결합 화합물의 이온화. 물의 자동이온화
[키워드] 탄소 양이온 기준, 카르보 양이온 기준, 탄소 음이온 기준, 카르보 음이온 기준, 이온화될 때 공유전자쌍 기준, 이온화될 때 결합전자쌍 기준, 탄소 양이온 사전, 카르보 양이온 사전, 탄소 음이온 사전, 카르보 음이온 사전, 이온화될 때 공유전자쌍 사전, 이온화될 때 결합전자쌍 사전, 이온화될 때 기준, 이온화될 때 사전, 이온화될 때 공유 전자쌍을 주고 기준, 이온화될 때 공유 전자쌍을 내놓고 기준, 이온화될 때 공유 전자쌍을 주고 사전, 이온화될 때 공유 전자쌍을 내놓고 사전, 공유 전자쌍을 주고 이온화 기준, 공유 전자쌍을 내놓고 이온화 기준, 공유 전자쌍을 주고 이온화 사전, 공유 전자쌍을 내놓고 이온화 사전, 공유 결합 물질의 이온화 기준, 공유 결합 화합물의 이온화 기준, 공유 결합 물질의 이온화 사전, 공유 결합 화합물의 이온화 사전
'일반화학 > [24장] 생명의 화학: 유기화학과 생화학' 카테고리의 다른 글
| [유기화합물 명명법] 2-methylheptane (1) | 2020.10.15 |
|---|---|
| [유기화합물 명명법] propan-2-one. acetone (1) | 2020.10.14 |
| [유기화합물 명명법] benzophenone (1) | 2020.10.14 |
| [유기화합물 명명법] 2-methylpropan-1-ol (0) | 2020.10.12 |
| [유기화합물 명명법] (1R,2S)-2-methylcyclohept-4-enol (2) | 2020.10.08 |
| [NIST] 화학식으로 화합물 검색 (0) | 2020.10.04 |
| [유기화합물 명명법] butan-2-one (0) | 2020.09.27 |
| [유기화합물 명명법] 2,4-dimethylpentan-3-one (0) | 2020.09.27 |




댓글