수소 원자는 별난 녀석
수소(H) 원자는 화학에서 좀 특별한(특이한) 녀석입니다.

[ 그림 출처 Wikimedia ] Hydrogen-1 atom.
▶ 원자 중 ‘유일하게’ 원자핵 속에 “중성자가 없습니다”.
▶ 수소 원자핵은 오로지 단 1개의 양성자로 이루어져 있고,
또한 오로지 단 1개의 전자를 갖고 있기 때문에,
전자 1개를 잃은 수소 이온(H^+)은 양성자와 같습니다.
( 참고 https://ywpop.tistory.com/2825 )
▶ 유일하게 동위원소별로 별도 이름을 갖고 있습니다.
( 참고 https://ywpop.tistory.com/16972 )
( 참고: 수소 동위원소 https://ywpop.tistory.com/4202 )
▶ 전자를 단 1개만 갖고 있기 때문에,
비금속 물질임에도 불구하고,
주기율표에서 1족에 위치하고 있습니다.
( 수소를 뺀 나머지 1족 원소는 전부 금속 )
▶ 이 때문에, 비금속 물질임에도 불구하고,
이온이 될 때, 일반적으로 전자 1개를 잃고 양이온이 됩니다.
( 즉, +1가의 산화수를 가집니다. )
H2O(l) ⇌ H^+(aq) + OH^-(aq)
▶ 단, 금속과 결합하여 화합물이 될 때는
–1가의 산화수를 갖기도 합니다.
NaH(s) → Na^+(g) + H^-(g)
( 참고 https://ywpop.tistory.com/9233 )
▶ 전자를 단 1개만 갖고 있기 때문에,
수소 원자 오비탈의 에너지 준위는
오로지 주양자수, n에 의해서만 결정됩니다.
나머지 모든 원자들은 (n+l) 규칙에 의해 결정됨.
( 참고 https://ywpop.tistory.com/2841 )
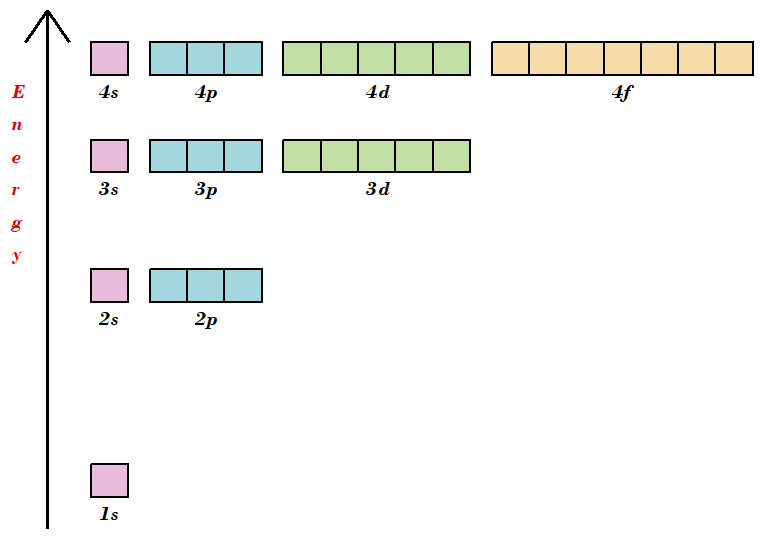
[그림] 수소 원자 오비탈의 에너지 준위.
[ 관련 글 https://ywpop.tistory.com/9247 ] 수소 원자 오비탈의 에너지 준위
[ 관련 글 https://ywpop.blogspot.com/2024/05/blog-post.html ]
수소 원자와 다전자 원자의 에너지 준위가 다른 이유
Why energy level of orbitals is different for hydrogen and other multi-electron atoms?
[ 관련 글 https://ywpop.tistory.com/11673 ] 왜 수소 이온은 수용액에서 H3O^+로 존재할까?
[키워드] 수소 원자 기준, 양성자 기준, 수소 원자는 악동 기준, 수소는 악동 기준, 수소는 별난 녀석 기준, 수소 원자 사전, 양성자 사전, 수소 원자는 악동 사전, 수소는 악동 사전, 수소는 별난 녀석 사전
'일반화학 > [22장] 비금속 화학' 카테고리의 다른 글
| 인. phosphorus. 5A족 (15족) 원소 (0) | 2021.01.13 |
|---|---|
| 공유결합 분자 모형. 할로겐 이원자분자 (0) | 2020.05.21 |
| 수소 화합물, 수소화물 (Hydrides) (0) | 2020.03.16 |
| 금속탄화물과 물의 반응식 (0) | 2020.02.20 |
| 할로겐 이원자분자의 물리적 상태 (0) | 2018.01.15 |
| 공기의 분리. 질소 제조. 산소 제조 (0) | 2017.11.27 |
| 2주기와 3주기 원소의 π 결합 (1) | 2017.07.23 |
| 산성산화물, 염기성산화물, 양쪽성산화물 ★ (0) | 2017.04.11 |



댓글