공유 결합 화합물의 공유 전자 수. CO2 NH3
필자는 ‘원자의 팔 (또는 손)’이라고 하는데,
화학 용어로는 ‘원자의 원자가’라고도 한다.
( 참고: 원자가 https://ywpop.tistory.com/21865 )
> H의 원자가 = 1
> C의 원자가 = 4
> N의 원자가 = 3
> O의 원자가 = 2
이므로,
( 그림 참고 https://ywpop.tistory.com/2872 )

[그림] C–H 결합.
C–H 결합 그림에서처럼,
C는 다른 원자와 결합할 수 있는 저런 팔이 4개이고,
H는 저런 팔이 1개뿐이다.
CO2는
O=C=O, 이렇게 구조식을 그릴 수 있는데,
선 1개 = 공유 전자쌍 1개 이므로,
CO2의 공유 전자 개수는
4 × 2 = 8개.
( 공유 전자쌍 개수 = 4개 )

[그림] CO2의 루이스 구조.
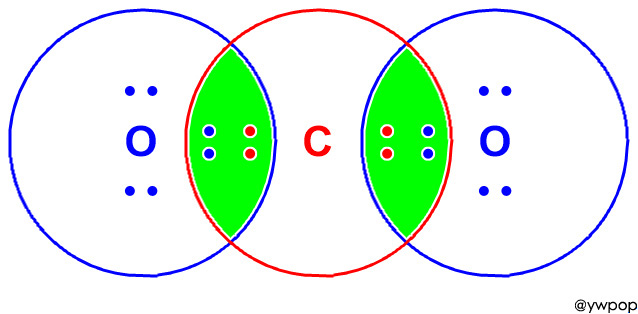
[그림] Electron dot structure of carbon dioxide, CO2.
녹색((green) 영역에 있는 전자들이 공유 전자들(8개)이며,
따라서 공유 전자쌍은 4쌍이다.

[그림] 집합 A와 B의 교집합을 표현한 벤 다이어그램.
공유 전자들은 교집합에 해당한다.
NH3는
N–H가 3개인 구조식을 그릴 수 있으므로,
NH3의 공유 전자 개수는
3 × 2 = 6개.
( 공유 전자쌍 개수 = 3개 )

[그림] NH3의 루이스 구조.
[키워드] 공유 전자 수 기준, 공유 전자 개수 기준, CO2 루이스 기준, NH3 루이스 기준, CO2 전자 점 구조 기준, CO2 전자 점 구조식 기준, CO2 전자 점 기준, CO2 electron dot dic, 교집합 기준, 교집합 사전, 공유 전자쌍 기준, 공유 전자쌍 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 오존의 평균 결합 엔탈피 (2) | 2023.05.17 |
|---|---|
| 칼륨의 이온화. 칼륨 양이온과 칼륨 음이온 (4) | 2023.04.22 |
| 수소의 이온화. 수소 양이온과 수소 음이온 (1) | 2023.04.22 |
| 원자가 전자의 수와 공유 전자쌍의 수 (0) | 2023.04.12 |
| 산소 원자의 형식 전하 계산 (0) | 2023.04.05 |
| 비활성기체의 전자배치와 NaCl의 결합 (1) | 2023.04.02 |
| Benzoic acid는 극성 분자인가 (1) | 2023.04.02 |
| 탄소 이온의 이온식 (0) | 2023.03.20 |



댓글