XeO3 루이스 구조 그리기
---------------------------------------------------
▶ 참고: 루이스 구조 그리기 [ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
(Xe) + 3(O) = (8) + 3(6) = 26
[2단계] 화합물의 기본 골격 구조를 그린다.
( Fig. 1. 참고 )
26 – 3(2) = 20
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( Fig. 2. 참고 )
20 – 3(6) = 2
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
( Fig. 3. 참고 )
2 – 2 = 0
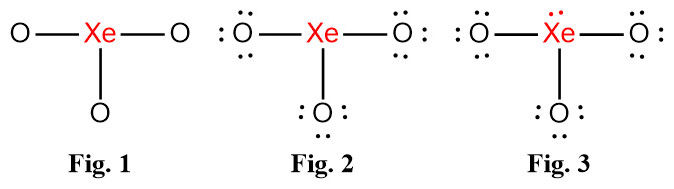
[5단계] Fig. 3. 루이스 구조의 형식전하를 계산해보면,
형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)
( 참고 https://ywpop.tistory.com/2544 )
> Xe의 형식전하 = 8 – 2 – (6/2) = +3
> O의 형식전하 = 6 – 6 – (2/2) = –1
---> 중성인 화합물에 형식전하가 존재하는 루이스 구조는
불안정한 구조이다.
[6단계] 이때 만약
① 중심 원자가 3주기 이상의 원자이고, and,
② 형식전하를 없앨 수 있다면,
---> 팔전자 (옥텟규칙) 를 초과할 수 있다.
---> 확장 팔전자 규칙 또는 18전자 규칙
( 참고: 18전자 규칙 https://ywpop.tistory.com/3752 )
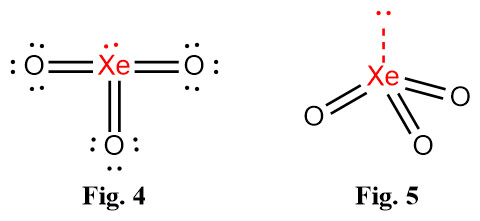
Fig. 4. 루이스 구조의 형식전하를 계산해보면,
> Xe의 형식전하 = 8 – 2 – (12/2) = 0
> O의 형식전하 = 6 – 4 – (4/2) = 0
▶ 중심원자의 전자영역 = 4개
---> 중심원자의 혼성오비탈 = sp3 혼성
---> 전자영역의 기하구조 = Tetrahedral
( 참고 https://ywpop.tistory.com/11542 )
▶ 4개 전자영역 중,
> 주위원자(X) = 3개
> 비공유전자쌍(Y) = 1개
---> AX3E1
---> 분자의 기하구조 = Trigonal pyramidal (Fig. 5.)

[그림] ball-and-stick model of of XeO3. 삼각뿔.
[키워드] XeO3 루이스, 제논 루이스, 크세논 루이스
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 결합차수 (σ_2s)^2 (σ*_2s)^2 (σ_2p)^2 (π_2p)^2 (π*_2p)^4 (0) | 2021.08.04 |
|---|---|
| methyl cyanoacrylate의 루이스 구조 (0) | 2021.08.02 |
| I3^+의 루이스 구조 (0) | 2021.07.13 |
| N2 > N2^+ 인 것. 결합차수 (0) | 2021.06.29 |
| SO2에 관한 다음 설명 중에서 옳은 것 (0) | 2021.06.12 |
| CO2 CH3OCH3 Br2 H2 CBr4 (0) | 2021.06.06 |
| 쌍극자 모멘트를 가질 수 있는 화합물. SF6 SO3 BrF3 (0) | 2021.06.05 |
| ClF3 루이스 구조. BrF3 루이스 구조. IF3 루이스 구조 (0) | 2021.06.05 |



댓글