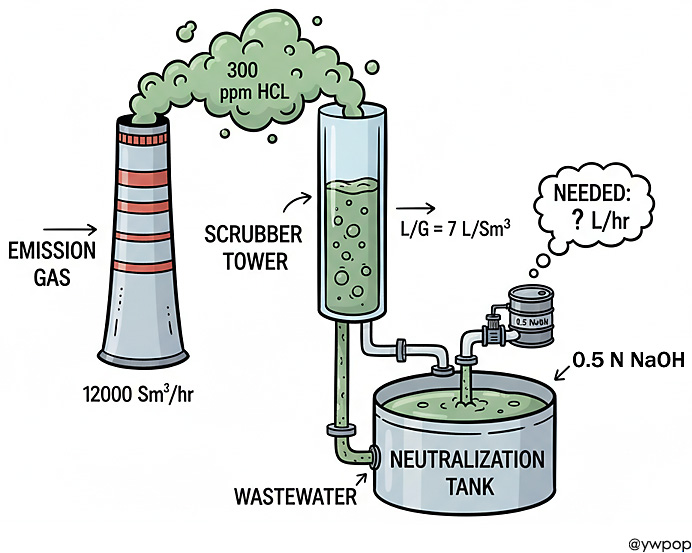
300 ppm HCl 12000 Sm3/hr 배출가스 액가스비 7 L/Sm3 세정탑
300 ppm의 HCl을 포함한
12000 Sm3/hr의 배출가스 처리를 위해,
액•가스비 7 L/Sm3의 세정탑을 사용하여
이 세정탑의 폐수를 중화하는데 필요한
0.5 N NaOH 용액의 필요량을 구하시오. (L/hr)
(단, 표준상태 기준. HCl은 100% 흡수한다.)
------------------------
※ “hr = 1 = 1시간” 으로 간주하여,
단위에 있는 hr을 생략하자.
1 ppm = 1 mL/m3 이므로,
( 참고 https://ywpop.tistory.com/12744 )
300 ppm = 300 mL/Sm3
= 300 mL HCl / 1 Sm3 배출가스
용액의 농도 × 용액의 부피 = 용질의 양
(mL/m3) × (m3) = mL
이므로,
배출가스 중 HCl의 부피를 계산하면,
(300 mL/Sm3) (12000 Sm3)
= 3600000 mL
= 3600 L
표준상태에서, 기체 1 mol = 22.4 L 이고,
( 참고: 몰부피 https://ywpop.tistory.com/8321 )
HCl의 당량수 = 1 eq/mol 이므로,
( 참고 https://ywpop.tistory.com/4105 )
HCl의 부피를 eq수로 환산하면,
(3600 L) (1 mol / 22.4 L) (1 eq/mol)
= (3600) (1 / 22.4)
= 160.7143 eq ... ①
---> HCl 용질의 eq수
1시간당 배출가스의 양 = 12000 Sm3 이고,
액•가스비 = 7 L/Sm3 이므로,
발생되는 염산 폐수의 부피를 계산하면,
12000 Sm3 × (7 L/Sm3)
= 84000 L ... ②
---> 폐수, 즉 수용액의 부피이다.
HCl 용액(폐수)의 노르말농도를 계산하면,
노르말농도(N) = 용질 eq수 / 용액 L수
( 참고 https://ywpop.tistory.com/6131 )
= ① / ②
= 160.7143 eq / 84000 L
= 0.001913 eq/L
= 0.001913 N
중화에 필요한 0.5 N NaOH 용액의 부피를 계산하면,
NV = N’V’
( 참고 https://ywpop.tistory.com/4689 )
(0.001913 N) (84000 L) = (0.5 N) (? L)
? = (0.001913) (84000) / (0.5)
= 321.38 L
답: 약 321.4 L
[ 관련 글 https://ywpop.tistory.com/17075 ]
400 ppm의 HCl을 함유하는 배출가스를 처리하기 위해
액가스비가 2 L/Sm3인 충전탑을 설계하고자 한다.
이때 발생되는 폐수를 중화하는데 필요한
시간당 0.5 N NaOH 용액의 양은?
(단, 배출가스는 400 Sm3/hr로 유입되며,
HCl은 흡수액인 물에 100% 흡수된다.)
[키워드] HCl 배출가스 기준, 액가스비 기준, 충전탑 설계 기준, 충전탑 기준, 세정탑 기준
'공학&기술' 카테고리의 다른 글
| 공기비 1.3에서 메탄을 연소시킨 경우 단열연소온도 (2) | 2026.01.28 |
|---|---|
| 질산성 질소 NO3-N 150 ppm 설정에 필요한 Ca(NO3)2*4H2O (7) | 2026.01.28 |
| 500 rpm 연삭숫돌 지름 300 mm 원주속도(m/min) (2) | 2025.11.09 |
| 마이크로미터 눈금 읽는 법 (5) | 2025.10.29 |
| 최소산소농도. Minimum Oxygen Concentration, MOC (4) | 2025.09.05 |
| penstock square knife gate valve (6) | 2025.09.01 |
| 청력보존 프로그램 기준 소음수준 85 dB(A) (3) | 2025.08.24 |
| 난방부하 6000 kcal/h 방열 면적 0.5 m2 5세주형 방열기 쪽수 (10) | 2025.07.17 |




댓글