NCS^- 루이스 구조 그리기. 티오시아네이트
Lewis structure of thiocyanate (SCN^-)
---------------------------------------------------
▶ 참고: 루이스 구조 그리기
[ https://ywpop.tistory.com/6302 ]
---------------------------------------------------
[1단계] 각 원자의 원자가전자 수의 합을 구한다.
(N) + (C) + (S) + 1 = (5) + (4) + (6) + 1 = 16
[2단계] 화합물의 기본 골격 구조를 그린다.

N–C–S
16 – 2(2) = 12
[3단계] 주위 원자들이 팔전자 규칙에 맞도록 전자를 한 쌍씩 그린다.
( 무조건, 그냥 주위 원자 주변에 전자쌍 3개씩 그린다. )
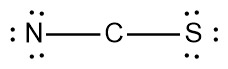
N(6)–C–S(6)
12 – 12 = 0
※ 괄호 안의 숫자는 비결합(비공유)전자 수
[4단계] 중심 원자도 팔전자 규칙에 맞도록 그린다.
> 남아있는 전자가 없으므로,
주위 원자의 비결합 전자쌍을 사용하여(당겨와서)
중심 원자도 팔전자 규칙에 맞도록 다중 결합을 그린다.
이때 다중 결합을 그리는 방법은 3가지가 가능한데,

> case 1: N(4)=C=S(4)
> case 2: N(6)–C≡S(2)
> case 3: N(2)≡C–S(6)
형식 전하를 계산해서 가장 안정한 루이스 구조를 결정해보자.
▶ 형식전하 = 원자가전자수 – 비결합전자수 – (결합전자수/2)

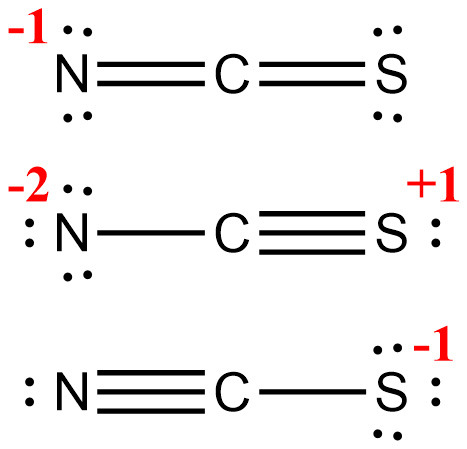
> 형식 전하가 가장 큰 case 2가 가장 불안정한 루이스 구조.
> N, S 중에서 전기음성도가 더 큰 N에 –1의 형식 전하가 할당되는 것이
논리적으로 더 타당하므로, case 1이 가장 안정한 루이스 구조.
N(4)=C=S(4)

[그림] Lewis structure of thiocyanate.
중심 원자 C의 전자 영역 = 2개 이므로,
> C의 혼성 오비탈 = sp
> 이온의 기하 구조 = 직선형
( 참고 https://ywpop.tistory.com/11542 )
[키워드] NCS^- 루이스 구조, SCN^- 루이스 구조
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 단일결합과 다중결합. bond rotation (0) | 2018.10.12 |
|---|---|
| N2F2 분자는 극성인가 무극성인가 ★ (0) | 2018.10.10 |
| CS2는 극성 분자? 무극성 분자? (0) | 2018.10.08 |
| N2H2 Lewis structure. N2H2 루이스 구조 (0) | 2018.10.02 |
| FNO의 루이스 구조. Lewis structure of FNO ★ (0) | 2018.07.12 |
| 삼염화질소의 루이스 구조. nitrogen trichloride. NCl3 (0) | 2018.07.10 |
| BeH2의 혼성 오비탈. 베릴륨의 혼성화. Be의 sp 혼성 오비탈 (1) | 2018.07.06 |
| 원자 오비탈(AO)의 혼성화 이론 정리 (3) | 2018.06.08 |




댓글