질소의 원자가 전자 수. 원자가. 결합수
------------------------
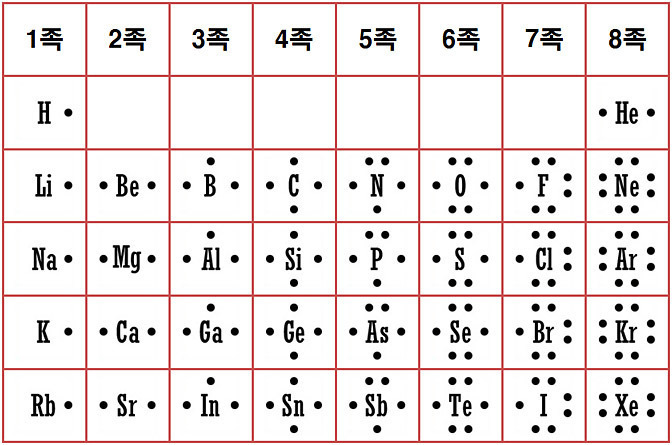
[그림] 루이스 전자 점 주기율표.
( 참고 https://ywpop.tistory.com/2872 )

질소의 원자가 전자 수 = 5개 또는
질소의 홀전자 수 = 3개 이므로,
질소의 원자가 또는 결합수 = 3.
---> 따라서 “중성 분자”에서,
질소는 3개의 결합을 할 수 있다. 또는
질소는 3개의 결합 선을 갖고 있어야 한다.
( 참고: 옥텟 규칙 https://ywpop.tistory.com/2634 )
중성 분자에서 질소가 3개의 결합을 하는 방법
1) 3개의 단일 결합: 예) ammonia, NH3
2) 1개의 단일 결합 + 1개의 이중 결합: 예) diazene, HN=NH
3) 1개의 삼중 결합: 예) dinitrogen, N≡N

[그림] 질소 원자의 다양한 결합 상태.
모든 질소 원자는 옥텟 규칙을 만족한다.
[참고] 중성 분자에서,
각 질소는 1개의 비공유(비결합) 전자쌍을 갖고 있다.
( 질소 원자의 루이스 점 기호를 보면,
질소 원자는 1개의 짝진 전자쌍을 갖고 있다. )
[참고] ammonium, NH4^+ 이온처럼,
1개의 비공유 전자쌍을
결합에 사용할 수도 있다.
단, 이때는 “중성 분자”가 아닌,
“이온”임에 주목할 것.
( 참고 https://ywpop.tistory.com/7656 )
[ 관련 글 https://ywpop.tistory.com/21865 ]
화학 결합에서 원자가와 결합 수
[키워드] 질소의 원자가 기준, 질소의 결합수 기준, 질소의 원자가 사전, 질소의 결합수 사전
'일반화학 > [08장] 화학결합의 기본 개념' 카테고리의 다른 글
| 탄화알루미늄 Al4C3는 이온결합인가 공유결합인가 (14) | 2026.01.29 |
|---|---|
| SiO4^4-는 공유결합 물질인데 왜 이온? (7) | 2026.01.28 |
| 양성자화된 amidine의 공명구조 (1) | 2025.10.19 |
| H2O 루이스 구조 그리기. 물 (5) | 2025.09.22 |
| 아세트아마이드의 결합각. CH3CONH2의 결합각 (14) | 2025.09.17 |
| 루이스 구조. COF2 H2O OF2 (5) | 2025.09.04 |
| SF5 molecular geometry (9) | 2025.07.17 |
| SiO4^4- 루이스 구조 그리기. silicate (4) | 2025.07.07 |




댓글