 물질의 상태 (States of Matter)
물질의 상태 (States of Matter) --------------------------------------------------- ▶ 참고: 제11장 액체와 분자간 힘. 목차 [ https://ywpop.tistory.com/15274 ] --------------------------------------------------- ▶ 물질의 상태 > 정상 상태(25℃, 1 atm 또는 상온, 상압)에서, 가장 안정한 상태 > 3가지 종류: 기체, 액체, 고체 ▶ 상온/상압 하 조건에서, 관찰할 수 있는 물질의 상태는 고체, 액체, 기체, 이렇게 3개 상태이다. [그림] States of matter. Solids, Liquids, and Gases. > 물질의 부피 = 물질이 차지하는 공간의 부..
2020. 8. 17.
물질의 상태 (States of Matter)
물질의 상태 (States of Matter) --------------------------------------------------- ▶ 참고: 제11장 액체와 분자간 힘. 목차 [ https://ywpop.tistory.com/15274 ] --------------------------------------------------- ▶ 물질의 상태 > 정상 상태(25℃, 1 atm 또는 상온, 상압)에서, 가장 안정한 상태 > 3가지 종류: 기체, 액체, 고체 ▶ 상온/상압 하 조건에서, 관찰할 수 있는 물질의 상태는 고체, 액체, 기체, 이렇게 3개 상태이다. [그림] States of matter. Solids, Liquids, and Gases. > 물질의 부피 = 물질이 차지하는 공간의 부..
2020. 8. 17.
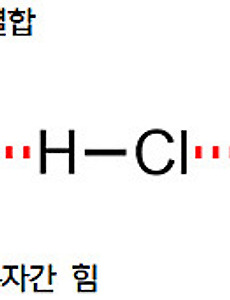 분자간 힘과 화학결합을 구별하자
분자간 힘과 화학결합을 구별하자 ▶ 분자간 힘 = 분자 사이의 상호작용 (인력) ▶ 화학결합 = 분자내 원자간 화학결합, 원자 사이의 화학결합 “분자간 힘(= 분자간 상호작용) = 반데르발스 힘” 이고,( 참고 https://ywpop.tistory.com/2579 ) 이온결합, 공유결합, 금속결합은분자간 힘이 아니다. 이온결합, 공유결합, 금속결합은“분자내 원자간 화학결합”이며,( 참고 https://ywpop.tistory.com/3036 ) 화학결합의 결합 세기(에너지)는분자간 힘의 세기와 비교할 수 없을 정도로 훨씬 더 크다. 예를 들면, 이온결합 (해리, 파괴)에너지는 400~4000 kJ/mol이고,수소결합 (해리, 파괴)에너지는 10~40..
2019. 5. 10.
분자간 힘과 화학결합을 구별하자
분자간 힘과 화학결합을 구별하자 ▶ 분자간 힘 = 분자 사이의 상호작용 (인력) ▶ 화학결합 = 분자내 원자간 화학결합, 원자 사이의 화학결합 “분자간 힘(= 분자간 상호작용) = 반데르발스 힘” 이고,( 참고 https://ywpop.tistory.com/2579 ) 이온결합, 공유결합, 금속결합은분자간 힘이 아니다. 이온결합, 공유결합, 금속결합은“분자내 원자간 화학결합”이며,( 참고 https://ywpop.tistory.com/3036 ) 화학결합의 결합 세기(에너지)는분자간 힘의 세기와 비교할 수 없을 정도로 훨씬 더 크다. 예를 들면, 이온결합 (해리, 파괴)에너지는 400~4000 kJ/mol이고,수소결합 (해리, 파괴)에너지는 10~40..
2019. 5. 10.
 물질의 상태변화. 승화
물질의 상태변화. 승화 [참고] 물질의 상태. States of Matter[ https://ywpop.tistory.com/15273 ] 일반적인 물질은, 가열하면 (또는 열을 흡수하면),고체 → 액체 → 기체, 이렇게 상태가 변합니다. 근데, 어떤 물질은, 가열하면 (또는 열을 흡수하면),고체 → 기체, 이렇게 상태가 변합니다.즉, 고체에서 액체를 거치지 않고 바로 기체가 됩니다. 이런 현상을 ‘승화’라 하고,이런 물질을 ‘승화성 물질’이라 합니다. 드라이아이스(고체 CO2), 나프탈렌(좀약)이 대표적인 승화성 물질입니다( 참고: 상평형도 https://ywpop.tistory.com/2602 ) [ 그림 출처 commons.wi..
2017. 11. 16.
물질의 상태변화. 승화
물질의 상태변화. 승화 [참고] 물질의 상태. States of Matter[ https://ywpop.tistory.com/15273 ] 일반적인 물질은, 가열하면 (또는 열을 흡수하면),고체 → 액체 → 기체, 이렇게 상태가 변합니다. 근데, 어떤 물질은, 가열하면 (또는 열을 흡수하면),고체 → 기체, 이렇게 상태가 변합니다.즉, 고체에서 액체를 거치지 않고 바로 기체가 됩니다. 이런 현상을 ‘승화’라 하고,이런 물질을 ‘승화성 물질’이라 합니다. 드라이아이스(고체 CO2), 나프탈렌(좀약)이 대표적인 승화성 물질입니다( 참고: 상평형도 https://ywpop.tistory.com/2602 ) [ 그림 출처 commons.wi..
2017. 11. 16.