완충용액에 강산 또는 강염기를 가했을 때 일어나는 현상
예) CH3COOH와 CH3COONa이 함께 용해되어있는 용액에다,

강산(H^+) 또는 강염기(OH^-)를 가하면, 어떻게 될까?
---------------------------------------------------
▶ 참고: 완충용액의 정의 [ https://ywpop.tistory.com/7093 ]
▶ 참고: Henderson-Hasselbalch 식 [ https://ywpop.tistory.com/1926 ]
---------------------------------------------------
▶ [약산] + [짝염기 + 강염기의 양이온으로 된 염] 을 포함한 완충용액
> 약산, CH3COOH의 짝염기 = CH3COO^-
> 강염기, NaOH의 양이온 = Na^+
> 짝염기 + 강염기의 양이온으로 된 염 = CH3COONa

(극히 일부만 존재하는 물질을 무시하면,)
CH3COOH 수용액에는 CH3COOH만 존재하고,
CH3COONa 수용액에는 CH3COO^-와 Na^+만 존재한다.
[주목] CH3COOH는 약산이다.
CH3COOH는 약산이기 때문에,
다음과 같은 이온화 반응은 극히 일부만 일어난다.
CH3COOH(aq) + H2O(aq) ⇌ H3O^+(aq) + CH3COO^-(aq)
따라서 CH3COOH 수용액 속에서
CH3COOH는 거의 대부분 CH3COOH 분자 형태로 존재한다.
---> CH3COOH(aq)로 존재.
완충용액의 약산과 짝염기에서
진짜 중요한 것은,
약산이란 CH3COOH이고,
짝염기란 CH3COO^-인데,
이 짝염기인 CH3COO^-는
약산에서 이온화된
CH3COOH(aq) ⇌ H^+(aq) + CH3COO^-(aq) 가 아니라,
( 약산은 극히 일부만 이온화된다는 것을 잊지말 것. )
염에서 이온화된
CH3COONa(aq) → Na^+(aq) + CH3COO^-(aq) 라는 것이다.
( 가용성염은 거의 100% 이온화된다는 것을 잊지말 것. )
[1] 산(H^+)을 가하면, 다음 반응에 의해 H^+ 이온이 소모된다.
( ∵ 공통이온효과 https://ywpop.tistory.com/2710 )
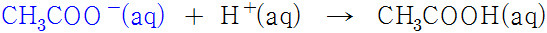
따라서 가한 강산에 의해 완충용액의 pH는 (거의) 변하지 않는다.
※ 그러나 이때 생성된 약산(CH3COOH)의 이온화 결과,
소량의 H^+ 이온이 생성되므로, pH는 약간 감소한다.
[2] 염기(OH^-)를 가하면, 다음 반응에 의해 OH^- 이온이 소모된다.
( ∵ 산-염기 중화반응 )

따라서 가한 염기에 의해 완충용액의 pH는 (거의) 변하지 않는다.
※ 그러나 이때 생성된 짝염기(CH3COO^-)의 가수분해 결과,
소량의 OH^- 이온이 생성되므로, pH는 약간 증가한다.
( 참고: 가수분해 https://ywpop.tistory.com/5502 )
[참고]
완충 용액에 산(H^+)을 가하면,
약산의 평형 반응에 H^+ 이온(공통 이온)이 존재하므로,
르샤틀리에의 원리에 따라 평형 이동(역방향)이 일어난다.
( 평형 이동에 의한 H^+ 감소 ---> pH 변화 거의 없음. )
그러나
완충 용액에 염기(OH^-)를 가하면,
약산의 평형 반응에 공통 이온이 존재하지 않으므로,
평형 이동이 일어나지 않는다.
( OH^-는 약산의 이온화 평형과 무관하다.
왜? 약산의 이온화 평형 반응식에 OH^-가 없기 때문에. )
이때는 산-염기 중화반응이 일어날 뿐이다.
( 산-염기 반응에 의한 OH^- 감소 ---> pH 변화 거의 없음. )
완충 용액에 산 또는 염기를 가했을 때,
완충 용액의 pH가 거의 일정하게 유지되는 과학적 원리는
이처럼 완전히 다르다.
학생들에게 이 둘을 구분해서 가르쳐야 되는데,
이 둘을 구분할 줄 아는 교사는 별로 없는 것 같다.
강산 또는 강염기를 가했을 때,
완충용액에서 일어나는 현상이 위와 같기 때문에,
[약산] : [짝염기] 또는 [약염기] : [짝산]의 농도 비는
1 : 1 일수록 좋은(효과적인) 완충용액이다.
[ 관련 글 https://ywpop.tistory.com/7181 ]
또한 이 때문에 완충용액을 만들 때,
만들고자 하는 완충용액의 pH와
거의 비슷한 pKa(또는 pKb) 값을 갖는
약산(또는 약염기)을 선택하는 것이다.
pH = pKa + log ([짝염기]/[약산])
[짝염기]/[약산] ≒ 1 이면, pH ≒ pKa
약산(또는 약염기)의 pKa(또는 pKb) 값 범위는
만들고자 하는 완충용액의 pH 값에서 ±1 이내일 것.
예를 들어, 완충용액의 pH 값이 4.5이면,
pKa 값은 3.5 이상, 5.5 이하일 것.
이 범위 밖의 pKa 값을 가진 약산을 선택하면,
강산 또는 강염기 양쪽 모두에
효과적으로 완충작용을 할 수 없다.
---------------------------------------------------



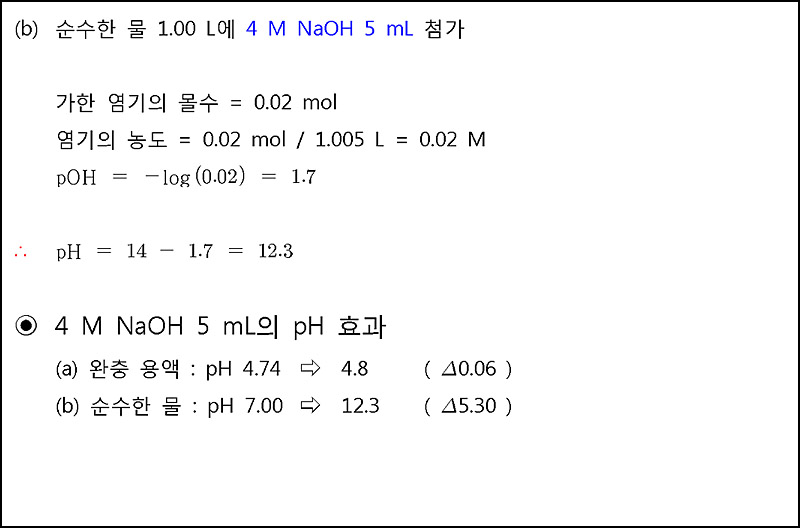
4 M HCl 용액 5 mL를
(a) pH가 4.74인 완충 용액 1 L에 가했을 때, pH는 0.06 감소(변화).
---> pH는 거의 변하지 않았다.
(b) pH가 7.00인 순수한 물 1 L에 가했을 때, pH는 5.30 감소(변화).
---> pH는 엄청나게 많이 변했다.


[ 관련 글 https://ywpop.tistory.com/19772 ] 완충용액에 강산 또는 강염기를 가하면
[ 관련 글 https://ywpop.tistory.com/5442 ] NH3-NH4Cl 완충용액의 완충작용
[ 관련 예제 https://ywpop.tistory.com/5785 ] 강산 및 강염기 첨가 후 완충 용액의 pH
[ 관련 예제 https://ywpop.tistory.com/16402 ] 아세트산 완충용액에 강산 첨가
[ 관련 예제 https://ywpop.tistory.com/16401 ] 아세트산 완충용액에 강염기 첨가
[키워드] 아세트산 완충용액 기준문서, 완충용액에 강산 기준문서, 완충용액에 강염기 기준문서, 아세트산 완충용액 사전, 완충용액에 강산 사전, 완충용액에 강염기 사전, 완충용액에 산 또는 염기 기준문서, 완충용액에 강산 또는 강염기 기준문서, 완충용액에 산 또는 염기 사전, 완충용액에 강산 또는 강염기 사전, 완충용액에 강산을 가하면 기준문서, 완충용액에 산을 가하면 기준문서, 완충용액에 강염기를 가하면 기준문서, 완충용액에 염기를 가하면 기준문서, 완충용액에 강산을 가하면 사전, 완충용액에 산을 가하면 사전, 완충용액에 강염기를 가하면 사전, 완충용액에 염기를 가하면 사전, 완충용액 경전
'일반화학 > [17장] 수용액 평형의 다른 관점' 카테고리의 다른 글
| 킬레이트 적정과 착물의 형성상수, Kf (1) | 2016.01.06 |
|---|---|
| 난용성염의 용해도와 pH. Mg(OH)2 (2) | 2015.12.22 |
| 이온곱, Q와 용해도곱 상수, Ksp 비교 (0) | 2015.12.14 |
| Ag3PO4의 몰용해도 계산. Ksp 1.8×10^(-18) (0) | 2015.12.09 |
| 형성 상수. HgI4^2- 착이온이 포함된 평형 농도 (0) | 2015.11.06 |
| 약산-강염기 적정에서 당량점에서의 pH가 7보다 높은 이유 (0) | 2015.10.16 |
| Hg2Cl2의 몰용해도. 염화수은(I), mercury(I) chloride (0) | 2015.05.18 |
| Ag2CrO4의 몰용해도 ★ (0) | 2015.04.08 |
댓글