연소분석과 그레이엄의 법칙으로 분자식 구하기. C5H5N
1.420 g의 C, H, N으로 이루어진 시료를
충분한 산소와 반응시켰을 때,
3.950 g의 CO2와 0.8086 g의 H2O가 생성되었다.
일정 온도와 압력 하에서, 0.01 L의 기체 상태의 시료는
0.01 L의 N2 기체보다 1.680배 더 느리게 확산되었다.
이 유기화합물의 분자식은 무엇인가?
When a 1.420 g sample of an organic compound
composed of carbon, C, hydrogen, H and nitrogen, N
was burned in excess oxygen,
3.950 g CO2 and 0.8086 g H2O were obtained.
In a separate experiment, it was found that,
for a fixed temperature and pressure,
a 0.0100 L gaseous sample of this compound takes
1.680 times longer to effuse
than does a 0.0100 L sample of N2(g).
What is the molecular formula of the compound?
---------------------------------------------------
▶ 참고: 원소분석 [ https://ywpop.tistory.com/64 ]
▶ 참고: CHN 연소분석 [ https://ywpop.tistory.com/3116 ]
---------------------------------------------------
연소 생성물로부터 각 원자의 질량을 계산하면,
> C의 질량
(3.950 g CO2) (1 mol CO2 / 44 g CO2) (1 mol C / 1 mol CO2) (12 g C / 1 mol C)
= 1.077 g C
> H의 질량
(0.8086 g H2O) (1 mol H2O / 18 g H2O) (2 mol H / 1 mol H2O) (1 g H / 1 mol H)
= 0.08984 g H
> N의 질량 = 1.420 – (1.077 + 0.08984) = 0.2532 g N
또는
> C의 질량 = 3.950 g × (12/44) = 1.077 g C
> H의 질량 = 0.8086 g × (2/18) = 0.08984 g H
> N의 질량 = 1.420 – (1.077 + 0.08984) = 0.2532 g N
각 원자의 질량을 몰수로 환산하면,
> C의 몰수 = 1.077 g / (12 g/mol) = 0.08975 mol C
> H의 몰수 = 0.08984 g / (1 g/mol) = 0.08984 mol H
> N의 몰수 = 0.2532 g / (14 g/mol) = 0.01809 mol N
몰수의 가장 작은 정수비를 계산하면,
C : H : N = 0.08975 : 0.08984 : 0.01809
= 0.08975/0.01809 : 0.08984/0.01809 : 0.01809/0.01809
= 4.96 : 4.97 : 1
≒ 5 : 5 : 1
---> 실험식 = C5 H5 N
---> 실험식량 = 5(12) + 5(1) + (14) = 79
시료는 N2 기체보다 1.680배 더 느리게 확산
---> N2의 확산 속도가 시료보다 1.680배 더 빠르다.
---> 시료의 속도 = 1 이면, N2의 속도 = 1.680
Graham의 법칙으로부터 시료의 분자량을 계산하면,
V_1 / V_2 = square root (M_2 / M_1)
( 참고 https://ywpop.tistory.com/3478 )
1.680 / 1 = (? / 28)^(1/2)
? / 28 = (1.680 / 1)^2
? = (1.680)^2 × 28 = 79.03
실험식량 ≒ 분자량 이므로,
분자식 = C5H5N
답: C5H5N
[키워드] 1.420 g C, H, N sample 3.950 g CO2 0.8086 g H2O 0.01 L N2 1.680, 1.420 g C H N sample 3.950 g CO2 0.8086 g H2O 0.0100 L N2 1.680 times
'화학 > 원소(연소)분석' 카테고리의 다른 글
| 원소 분석 (0) | 2016.01.23 |
|---|---|
| 분자량과 원소 분석 결과로부터 분자식 구하기 (1) | 2015.11.17 |
| 원소 분석 결과 실험식 구하기 (0) | 2015.11.02 |
| 연소분석(원소분석). 탄소의 질량을 구할 때 왜 이산화탄소의 질량을 사용하나요? (0) | 2015.10.16 |
| 흥분제 암페타민(C9H13N) 연소분석. amphetamine combustion analysis (0) | 2015.05.03 |
| 실험식 구할 때 정수 결정 방법 (2) | 2015.04.28 |
| 연소반응 생성물로부터 실험식, 분자식 결정하기 (0) | 2015.04.27 |
| 리비히(Liebig) 분석법에서 염화칼슘과 수산화칼륨의 순서 (2) | 2015.04.24 |

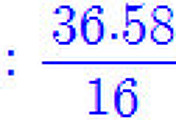
댓글