흥분제 암페타민(C9H13N) 연소분석. amphetamine combustion analysis
흥분제 암페타민은 탄소, 수소, 질소만으로 되어 있다.
이 물질 42.92 mg을 연소 분석하였더니
CO2 125.75 mg과 H2O 37.187 mg이 생겼다.
암페타민 분자의 몰질량이 135 g/mol이라면
분자식은 무엇인가?

The stimulant amphetamine contains only C, H, and N.
Combustion analysis of a 42.92 mg sample of amphetamine
gives 37.187 mg of H2O and 125.75 mg of CO2.
If the molar mass of amphetamine is less than 160 g/mol,
what is its molecular formula?
[참고] 원소분석 [ https://ywpop.tistory.com/64 ]
[참고] CH 연소분석 [ https://ywpop.tistory.com/9606 ]
[참고] CHO 연소분석 [ https://ywpop.tistory.com/2854 ]
[참고] CHN 연소분석 [ https://ywpop.tistory.com/3116 ]
계산 과정을 간단히 나타내고자, mg을 g으로 바꾸었습니다.
화학량론적으로 반응이 일어나기 때문에, 이렇게 해도 결과는 같습니다.
문제의 지문을 정리하면 다음과 같습니다.

[실험식 계산 순서]
① 연소 생성물로부터 원자의 질량 계산
> C 질량 ⇐ CO2 질량
> H 질량 ⇐ H2O 질량
> N 질량 = [시료 질량] – [(C + H) 질량]
② 원자의 질량으로부터 원자의 몰수 계산: g → 몰수
③ 원자의 몰수를 간단한 정수비로 나타내기
---------------------------------------------------

---------------------------------------------------
[실험식과 몰질량(분자량)으로 분자식 구하기]
분자식을 구하기 위해서는
실험식량(실험식에 나오는 원자량의 합)을 알아야 합니다.
실험식 = C9 H13 N 이므로,
실험식량 = 9(12) + 13(1) + (14) = 135
몰질량(= 분자량)이 135 g/mol이므로,
분자량 / 실험식량 = 135 / 135 = 1 = n
분자식 = n(실험식) = 1(C9 H13 N1) = C9 H13 N
답: 분자식 = C9H13N
[참고] “몰질량이 160 g/mol 미만인 경우”로 주어진 경우
실험식량 = 135 이므로,
① n = 1 이면, 분자량 = 1 × 135 = 135
② n = 2 이면, 분자량 = 2 × 135 = 270
---> 160 미만이므로, n = 1
---> 분자식 = C9H13N
[키워드] 암페타민 기준, amphetamine dic, amphetamine sample 42.92 mg 37.187 mg H2O 125.75 mg CO2
[FAQ] [①24/04/17]
'화학 > 원소(연소)분석' 카테고리의 다른 글
| 분자량과 원소 분석 결과로부터 분자식 구하기 (1) | 2015.11.17 |
|---|---|
| 원소 분석 결과 실험식 구하기 (0) | 2015.11.02 |
| 연소분석(원소분석). 탄소의 질량을 구할 때 왜 이산화탄소의 질량을 사용하나요? (0) | 2015.10.16 |
| 연소분석과 그레이엄의 법칙으로 분자식 구하기. C5H5N (0) | 2015.06.16 |
| 실험식 구할 때 정수 결정 방법 (2) | 2015.04.28 |
| 연소반응 생성물로부터 실험식, 분자식 결정하기 (0) | 2015.04.27 |
| 리비히(Liebig) 분석법에서 염화칼슘과 수산화칼륨의 순서 (2) | 2015.04.24 |
| 36.8% 질소와 63.0% 산소로 이루어진 화합물의 실험식: N2O3 (1) | 2015.04.20 |
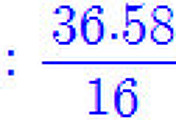
댓글