98% 황산 용액의 몰농도 (d 1.84)
98% H2SO4 용액(d 1.84)의 몰농도를 구하시오.
※ 용액은 균일 혼합물이므로,
용액의 농도는 용액의 양에 상관없다,
용액의 농도는 용액의 양과 무관하다.
황산 용액이 100 g 있다고 가정하면,
( 용액이 100 g 있든, 13 g, 91 g, 7777 g 있든
조성은 동일하므로, 계산하기 편하게 100 g이라 가정함. )
98 g 황산 + 2 g 물 = 100 g 용액
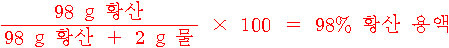
또는
98% 황산 용액 = (98 g 황산 / 100 g 용액) × 100 이므로,
( 참고 https://ywpop.tistory.com/2656 )
① 98 g 황산의 몰수(mol) 계산
② 100 g 용액의 부피(L) 계산
③ 몰농도 = 용질 mol수 / 용액 L수 = ① / ②
(1) H2SO4의 몰질량 = 98 g/mol 이므로,
98 g 황산의 몰수를 계산하면,
98 g / (98 g/mol) = 1 mol 황산
( 참고 https://ywpop.tistory.com/7738 )
(2) 98% 황산 용액의 밀도 = 1.84 g/mL 이므로,
100 g / (1.84 g/mL) = 54.35 mL = 0.05435 L 용액
( 참고 https://ywpop.tistory.com/8460 )
또는
(100 g) (1 mL / 1.84 g) (1 L / 1000 mL)
= (100) (1 / 1.84) (1 / 1000) = 0.05435 L 용액
(3) 몰농도 = 용질 mol수 / 용액 L수
= 1 mol / 0.05435 L = 18.3993 M 용액
( 참고 https://ywpop.tistory.com/3222 )
또는
[% → M] 변환공식으로 98% H2SO4의 몰농도를 계산하면,
몰농도 = (wt% / 몰질량) × 밀도 × 10
= (98 / 98) × 1.84 × 10 = 18.4 M
( 참고 https://ywpop.tistory.com/4241 )
답: 18.4 M
[참고] 만약 H2SO4의 몰질량 = 98.08 g/mol 을 사용하면,
몰농도 = (98 / 98.08) × 1.84 × 10 = 18.3850 M
---------------------------------------------------
A sample of commercial sulfuric acid is 96.4% H2SO4 by mass,
and its density is 1.84 g/mL.
Calculate the molarity of this sulfuric acid solution.
---------------------------------------------------
몰농도 = (wt% / 몰질량) × 밀도 × 10
= (96.4 / 98) × 1.84 × 10 = 18.0996 M
≒ 18.1 M
[ 관련 글 https://ywpop.tistory.com/23034 ] 96% w/w 황산(d 1.84, FW 98)의 노르말농도(N)
[키워드] 98% 황산 기준, 98% 황산의 몰농도 기준, 시중에 판매되는 농황산 기준, 98% 황산 몰농도 기준, 98% 황산 몰농도 사전
'화학 > 용액의 농도' 카테고리의 다른 글
| 퍼센트농도. w/w, v/v, w/v and v/w mean? ★ (0) | 2015.01.22 |
|---|---|
| 산-염기의 노르말농도(Normality, N) ★ (1) | 2014.12.18 |
| 물의 몰농도(M)는 55.6 M. Molarity of Water (1) | 2014.12.15 |
| 같은 질량의 글리세롤(C3H8O3)과 물을 포함하는 용액의 농도 (0) | 2014.10.09 |
| 몰농도(molarity, M), 몰랄농도(molality, m) ★ (8) | 2014.07.07 |
| 몰분율 (mole fraction) ★ (3) | 2014.07.04 |
| 백만분율(ppm), 십억분율(ppb) ★ (6) | 2014.07.03 |
| 질량 백분율 (퍼센트 농도) ★ (2) | 2014.07.03 |



댓글