탄소(carbon), 산소(oxygen)의 혼성 오비탈(hybrid orbital)
---------------------------------------------------
▶ 참고: 혼성 오비탈. hybrid orbital
[ https://ywpop.tistory.com/2639 ]
---------------------------------------------------
[1] 탄소(carbon)의 sp3 혼성 오비탈
( 예: Methane, CH4 분자에서 C의 혼성 오비탈 )

> s 오비탈 1개와 p 오비탈 3개를 혼합해서 만들었다고, sp3 혼성 오비탈이라 명명.
> 홀전자를 가진 4개의 sp3 혼성 오비탈 → 4개의 시그마 결합(σ-bond) 형성.

[ 그림 출처 Wikimedia ] A = carbon. 4개의 sp3 혼성 오비탈.
예) CH4. 메탄의 경우, 4개의 sp3 혼성 오비탈 → 4개의 결합 전자쌍 형성.
4개의 sp3 혼성 오비탈이 전부 똑같은 결합 전자쌍이므로,
메탄의 결합 각도는 정확히 109.5°.
[2] 탄소(carbon)의 sp2 혼성 오비탈
( 예: Ethene or ethylene, C2H4 분자에서 C의 혼성 오비탈 )

> 들뜸 과정은 sp3 혼성과 동일. 단, 1개의 p 오비탈을 남겨두고 혼성화.
> 3개의 sp2 혼성 오비탈 → 3개의 시그마 결합(σ-bond) 형성.
> 1개의 비혼성 오비탈(p_z) → 1개의 파이 결합(π-bond) 형성.

[그림] sp2 hybrid orbitals of carbon.
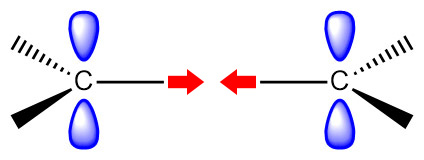
[그림] sp2 탄소 - sp2 탄소 결합.
sp2-sp2 C–C sigma bond.
[3] 탄소(carbon)의 sp 혼성 오비탈
( 예: Acetylene or ethyne, C2H2 분자에서 C의 혼성 오비탈 )

> 들뜸 과정은 sp3 혼성과 동일. 단, 2개의 p 오비탈을 남겨두고 혼성화.
> 2개의 sp 혼성 오비탈 → 2개의 시그마 결합(σ-bond) 형성.
> 2개의 비혼성 오비탈(p_y, p_z) → 2개의 파이 결합(π-bond) 형성.

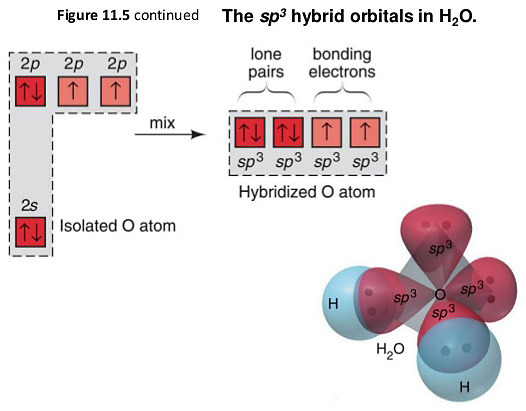
[4] 산소(oxygen)의 sp3 혼성 오비탈
( 예: Water, H2O 분자에서 O의 혼성 오비탈 )

> 들뜸 과정 없이, 바로 혼성화.
> 홀전자를 가진 2개의 sp3 혼성 오비탈 → 2개의 시그마 결합(σ-bond) 형성.
> 짝진 전자를 가진 2개의 sp3 혼성 오비탈
→ 2개의 비공유 전자쌍(비결합 전자쌍, non-bonding electron pairs) 가짐.
→ 짝진 전자를 가진 오비탈은 결합을 형성할 수 없다.
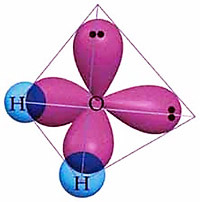
예) H2O. 2개의 결합 전자쌍과 2개 비공유 전자쌍으로 이루어진 4개의 sp3 혼성 오비탈.
물리적으로 덩치가 더 큰 비공유 전자쌍 때문에,
( 참고 https://ywpop.tistory.com/2571 )
물의 결합 각도는 109.5° 보다 작다.
[ 그림 출처 Wikimedia ]
[5] 산소(oxygen)의 sp2 혼성 오비탈
( 예: O2 분자에서 O의 혼성 오비탈 )

> 들뜸 과정 없이, 바로 혼성화.
> 1개의 sp2 혼성 오비탈 → 1개의 시그마 결합(σ-bond) 형성.
> 1개의 비혼성 오비탈(p_z) → 1개의 파이 결합(π-bond) 형성.
> 짝진 전자를 가진 2개의 sp2 혼성 오비탈
→ 2개의 비공유 전자쌍(비결합 전자쌍, non-bonding electron pairs) 가짐.
→ 짝진 전자를 가진 오비탈은 결합을 형성할 수 없다.
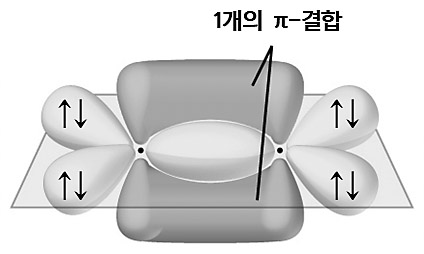
[그림] O2 분자의 혼성 오비탈.
[참고] 질소의 혼성 오비탈(hybridization of nitrogen)은
탄소의 각 혼성 오비탈에다 전자 1개를 추가하기만 하면 된다.
이것은 탄소의 각 혼성 오비탈에다 전자 2개를 추가하면
산소의 혼성 오비탈이 되는 것과 같은 원리이다.
예) 질소의 sp2 혼성 오비탈
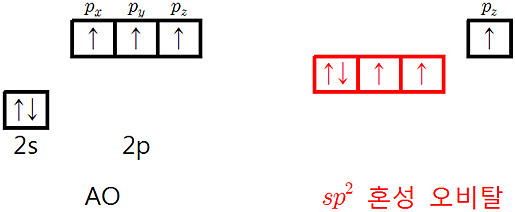
( 참고: 질소의 혼성 오비탈 https://ywpop.tistory.com/9952 )
[키워드] 탄소의 혼성 오비탈 기준문서, 산소의 혼성 오비탈 기준문서, 질소의 혼성 오비탈 기준문서, 물의 혼성 오비탈 기준문서, 산소 분자의 혼성 오비탈 기준문서, H2O의 혼성 오비탈 기준문서, O2의 혼성 오비탈 기준문서, O2 분자의 혼성 오비탈 기준문서, 탄소의 혼성 오비탈 사전, sp2-sp2 결합 기준, sp2-sp2 결합 사전, sp2-sp2 bond 기준, sp2-sp2 bond dic
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 루이스 구조(Lewis structure) 그리기. SO2 ★ (9) | 2015.06.15 |
|---|---|
| 분자의 자기적 성질. magnetic properties of molecules ★ (0) | 2015.03.13 |
| MO Diagrams of O2, F2, Ne2 (1) | 2014.12.06 |
| Lewis dot structure of H3PO4 (phosphoric acid) (0) | 2014.11.20 |
| 분자 오비탈 전자 배치, 질소 분자(N2), 이온 (0) | 2014.10.22 |
| 분자 오비탈 전자 배치. 산소 분자(O2), 이온(O2^2-) (0) | 2014.10.21 |
| NO2 NO2^+ NO2^- NO NO^-의 루이스 구조식 ★ (5) | 2014.09.29 |
| 혼성 오비탈 (hybrid orbital) ★ (9) | 2014.06.27 |




댓글