395 K에서 NH4HS(s) ⇌ NH3(g) + H2S(g) 반응의 Kp와 Kc
395 K에서 다음 평형을 생각해 보자.
NH4HS(s) ⇌ NH3(g) + H2S(g)
각 기체들의 부분 압력은 모두 0.265 atm이다.
이 반응의 Kp와 Kc를 계산하시오.
Consider the following equilibrium at 395 K:
NH4HS(s) ⇌ NH3(g) + H2S(g)
The partial pressure of each gas is 0.265 atm.
Calculate Kp and Kc for the reaction.
---------------------------------------------------
ICE 도표를 작성하면,
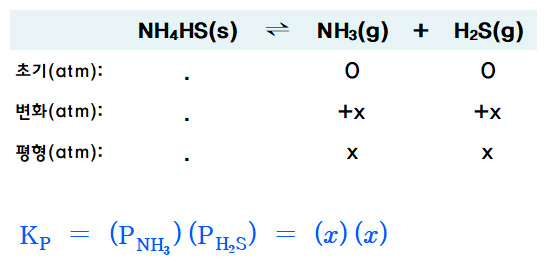
Kp = P_NH3 × P_H2S
= (0.265 atm) (0.265 atm)
= 0.0702
Kp = Kc(RT)^Δn
( 참고 https://ywpop.tistory.com/6523 )
Δn = 기체 생성물의 몰수의 합 – 기체 반응물의 몰수의 합
= (1 + 1) – (0) = 2
Kc = Kp / (RT)^Δn
= 0.0702 / (0.08206 × 395)^2
= 6.68×10^(-5)
답: Kp = 0.0702, Kc = 6.68×10^(-5)
[ 관련 예제 https://ywpop.tistory.com/22430 ] 295 K 0.265 atm Kc NH4HS(s) ⇌ NH3(g) + H2S(g)
[키워드] 395 K 0.265 atm Kc NH4HS(s) ⇌ NH3(g) + H2S(g)
[FAQ] [①22/06/17]
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| 평형상수와 반응비. 반응지수, reaction quotient, Q_C ★ (0) | 2019.01.21 |
|---|---|
| 물의 평형상수. 물의 평형. water equilibrium (1) | 2019.01.08 |
| Br(g)의 질량. 0.200 L 용기에 0.245 g Br2(g) (1) | 2018.11.07 |
| 르샤틀리에 원리. 암모니아 합성 시 부피 변화 (0) | 2017.12.23 |
| 2000℃ Kc 2.4×10^3 2NO(g) ⇌ N2(g) + O2(g) 0.175 M (0) | 2017.10.20 |
| 평형상수와 용해도곱상수 (0) | 2017.06.18 |
| 평형 상수 (equilibrium constant), K ★ (0) | 2017.05.16 |
| 평형상수 식에서 순수한 고체, 액체, 용매의 농도는 1 (0) | 2017.05.06 |

댓글