약산(CH3COOH) <- 강염기(NaOH) 중화 적정. 적정 중 용액의 pH
0.1 M CH3COOH 200 mL + 0.1 M NaOH 50 mL 용액의 pH
(1) 0.1 M CH3COOH 200 mL에 0.1 M NaOH 50 mL를 가했을 때, 용액의 pH는?
(CH3COOH의 pka = 4.76)
---------------------------------------------------
▶ 참고: 약산-강염기 적정 시뮬레이션
[ https://ywpop.tistory.com/2736 ]
---------------------------------------------------
0.1 M CH3COOH 200 mL에 포함된 CH3COOH의 몰수
= (0.1 mol/L) × 0.200 L = 0.020 mol
0.1 M NaOH 50 mL에 포함된 NaOH의 몰수
= (0.1 mol/L) × 0.050 L = 0.005 mol
산-염기 중화 반응식
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH : NaOH : CH3COONa = 1 : 1 : 1 계수비(= 몰수비) 이고,
몰수가 작은 NaOH가 한계 반응물이므로,
( 참고: 한계 반응물 https://ywpop.tistory.com/3318 )
반응한 CH3COOH의 몰수 = 반응한 NaOH의 몰수 = 생성된 CH3COONa의 몰수
= 0.005 mol
반응 후 남아있는 CH3COOH의 몰수
= 0.020 mol – 0.005 mol = 0.015 mol
약산-강염기 적정 중에는 완충용액이 형성되므로,
용액의 pH는 Henderson-Hasselbalch 식으로 계산한다.
( 참고 https://ywpop.tistory.com/2727 )
pH = pKa + log([짝염기] / [약산])
= 4.76 + log(0.005 / 0.015)
= 4.28
(2) 이 용액에다 0.2 M NaOH 25 mL를 더 가했을 때, 용액의 pH는?
---------------------------------------------------
이 용액에다 0.2 M NaOH 25 mL를 더 첨가하면,
0.2 M NaOH 25 mL에 포함된 NaOH의 몰수
= (0.2 mol/L) × 0.025 L = 0.005 mol
생성된 CH3COONa의 몰수
= 0.005 mol + 0.005 mol = 0.010 mol
반응 후 남아있는 CH3COOH의 몰수
= 0.015 mol – 0.005 mol = 0.010 mol
pH = pKa + log([짝염기] / [약산])
= 4.76 + log(0.010 / 0.010)
= 4.76
[키워드] CH3COOH + NaOH 완충용액 기준문서
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 10^–7 M HCl, 10^–8 M HCl과 같은 묽은 염산의 pH ★ (7) | 2015.11.09 |
|---|---|
| 탄산나트륨(sodium carbonate, Na2CO3)의 노르말농도(normality) (0) | 2015.10.22 |
| 약산의 산 이온화상수(산 해리상수), Ka와 pKa (0) | 2015.10.21 |
| 약산 0.060 M 용액의 pH가 3.44일 때, Ka 계산 (0) | 2015.10.18 |
| 0.01 M HCl 용액과 0.10 M KOH 용액의 pH (0) | 2015.10.14 |
| 0.01 M 암모니아 수용액의 이온화도는 4.3% (0) | 2015.10.05 |
| CaCl2 수용액의 pH(산도)는 산성 (2) | 2015.08.10 |
| 0.2 M HCl 50 mL + 0.1 M NaOH 50 mL 용액의 pH는 1.3 (2) | 2015.07.15 |
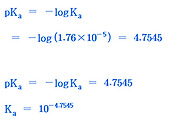
댓글