기체의 밀도와 몰질량 (몰분자량, 분자량)
Determining the density and molar mass of a gas
from the ideal gas law
▶ 밀도의 정의

밀도 = 질량 / 부피 (단위: g/L)
( 참고 https://ywpop.tistory.com/8460 )
From 이상 기체 방정식,

> M은 기체의 분자량 (= 몰질량).
( 참고: 몰질량 https://ywpop.tistory.com/7113 )
> W는 기체의 실제 질량 (저울 등으로 측정한 또는 계산한).
( 참고: PV = nRT https://ywpop.tistory.com/3097 )
n/V = P/RT 식 양변에 몰질량(g/mol), M을 곱하면

nM/V는 밀도와 같은 단위(g/L)를 가지므로,
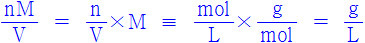
따라서
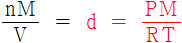
d = PM / RT
> R = 0.08206 atm•L/mol•K
( 참고 https://ywpop.tistory.com/2933 )
※ 기체의 밀도(d)는 압력(P), 몰질량(M), 온도(T)에 의존.
※ 기체의 밀도 단위는 g/L.
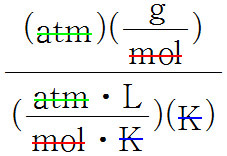
또한 기체의 밀도를 알면,
다음 식으로부터 기체의 몰질량을 구할 수 있다.
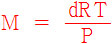
M = dRT / P
> R = 0.08206 atm•L/mol•K
( 참고 https://ywpop.tistory.com/2933 )
[예제] STP에서 밀도가 1.96 g/L인 기체의 분자량은?

[주의] 기체 상수, R의 압력 단위가 atm이므로,
만약 압력 단위가 atm이 아닌 mmHg 등으로 주어졌다면,
반드시 atm 단위로 환산해서 공식에 대입해야 된다.
> 1 atm = 760 mmHg
[예제] 30℃, 740 mmHg 조건에서,
기체 6.05 g이 2.75 L를 차지할 때 이 기체의 몰질량은?
M = dRT / P
= (6.05 / 2.75) (0.08206) (273.15+30) / (740/760)
= 56.2 g/mol
[예제] 0℃, 1기압에서 밀도가 1.25 g/L인 기체의 분자량은?
M = dRT / P
= (1.25) (0.08206) (273.15+0) / (1)
= 28.02 g/mol
---------------------------------------------------
▶ 표준 온도와 압력(standard temperature and pressure, STP)
> 0℃, 1 atm
▶ STP에서, 기체 1 mol의 부피 = 22.414 L
( 참고: 몰부피 https://ywpop.tistory.com/8321 )
PV = nRT 로부터, STP에서 기체 1 mol의 V를 계산하면,
V = nRT / P
= (1) (0.082057338) (273.15) / (1)
= 22.413962 L
= 22.414 L
M = dRT / P 에서, STP 조건이면,
RT / P = [(0.082057338 atm•L/mol•K) (273.15 K)] / (1 atm)
= 22.414 L/mol
이므로,
M = d × 22.414
분자량 = 밀도 × 22.414
(g/mol) = (g/L) × (L/mol)
[예제] STP에서 밀도가 1.43 g/L인 기체의 분자량은?
M = d × 22.414
= (1.43 g/L) × (22.414 L/mol)
= 32.05 g/mol
[예제] 20℃, 101 kPa에서 산소 기체의 밀도(kg/m3)
> O2의 몰질량 = 32 g/mol = 0.032 kg/mol
1 J = 1 Pa•m3 이므로,
R = 8.314 J/mol•K
= 8.314 Pa•m3/mol•K
d = PM / RT
= [(101000 Pa) (0.032 kg/mol)]
/ [(8.314 Pa•m3/mol•K) (273.15 + 20 K)]
= [(101000) (0.032)] / [(8.314) (273.15 + 20)]
= 1.326 kg/m3
( 참고 https://ywpop.tistory.com/471217 )
[ 관련 글 https://ywpop.blogspot.com/2025/01/37-200-kpa-n2-kgm3.html ]
37℃, 200 kPa 상태의 N2의 밀도는 약 몇 kg/m3인가? (단, N의 원자량은 14이다.)
[ 관련 글 https://ywpop.blogspot.com/2024/08/0-1-068-gl.html ]
0℃ 1기압에서 밀도가 0.68 g/L인 기체의 분자량 ★
[ 관련 글 https://ywpop.tistory.com/24579 ]
78.07% N2 + 20.97% O2 + 0.96% Ar인 20℃, 1 atm 공기의 밀도
[ 관련 글 https://ywpop.blogspot.com/2024/04/194-ml-100-0976-atm-0477-g-mol-mass.html ]
100℃와 0.976 atm에서 어떤 시료의 질량이 0.477 g이었다. 이 화합물의 몰질량은 얼마인가? 100℃ 0.976 atm 0.477 g mol mass 100℃ 0.976 atm sample mass 0.477 g compound mol mass
[키워드] 기체의 밀도와 분자량 기준, 기체의 분자량과 밀도 기준, 기체의 몰부피 기준, 기체의 밀도 기준, 기체의 밀도와 분자량 사전, 기체의 분자량과 밀도 사전, 기체의 밀도 사전, 기체의 밀도와 몰질량 기준, 기체의 몰질량과 밀도 기준, 기체의 밀도와 몰질량 사전, 기체의 몰질량과 밀도 사전
'일반화학 > [10장] 기체' 카테고리의 다른 글
| 분압법칙과 수상포집, collection of gas over water (4) | 2015.05.30 |
|---|---|
| VT는 일정. 88℃ 9.6 L 수소 기체 3.4 L 온도는 (0) | 2015.05.28 |
| 켈빈온도(K)와 섭씨온도(℃). Kelvin scale and Celsius scale (6) | 2015.03.19 |
| 이상 기체 방정식 유도. PV=nRT ★ (4) | 2014.12.21 |
| 기체 상수 (gas constant), R ★ (0) | 2012.10.23 |
| 기체의 양-부피 관계. 아보가드로의 법칙 (Avogadro’s law) ★ (0) | 2012.10.19 |
| 기체의 온도-부피 관계, 샤를의 법칙(Charles's law) ★ (0) | 2012.10.19 |
| 기체의 압력-부피 관계, 보일의 법칙(Boyle's law) ★ (0) | 2012.10.19 |




댓글