pH 값, 산도의 측정
이 수용액은 산성인가? 염기성인가?
---------------------------------------------------
▶ 참고: 제16장 산-염기 평형. 목차
[ https://ywpop.tistory.com/15336 ]
---------------------------------------------------
25℃, 순수한 물 속에 존재하는 H^+ 이온의 농도는

‘0 . 0 0 0 0 0 0 1’ 이란 숫자는 너무 작은 값이라서 사용하기 불편하다.
그래서 이 값에다 log를 곱했더니,
log(0 . 0 0 0 0 0 0 1) = –7
한자리수의 정수가 나온다.
그런데 이번엔 마이너스 부호가 눈에 그슬리네...
그래서 log 앞에 마이너스를 곱해주면,
–log(0 . 0 0 0 0 0 0 1) = 7
‘0.0000001’이란 작은 수를 간단히 ‘7’로 나타낼 수 있다.
이거 엄청 편리하군.
수용액에 존재하는 H^+ 이온의 농도 값에
–log를 곱한 값을 ‘pH’라 부르자(정하자).
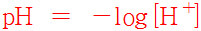
pH = –log[H^+]
---------------------------------------------------
▶ Definition of pH
> The pH value of a solution is the negative log of its [H^+].
[참고] The equation for calculating pH was proposed in 1909
by Danish chemist Søren Peder Lauritz Sørensen.
▶ What does pH stand for?
> pH stands for “power of hydrogen”
( 출처 https://www.thoughtco.com/what-does-ph-stand-for-608888 )
> 수소 이온 농도 지수 또는 수소 농도 지수
> potential of hydrogen or power of hydrogen
---------------------------------------------------
▶ pH 값이란?
> 수용액 중 H^+ 이온 농도를 (사용하기 편리하도록) 나타낸 값.
▶ pH 값을 알면(보면), 수용액의 산도를 알 수 있다.
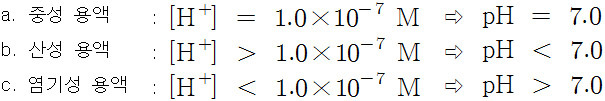
a. pH < 7 이면, 산성 용액
b. pH = 7 이면, 중성 용액
c. pH > 7 이면, 염기성 용액
▶ 일반적으로 수용액의 pH는 ‘pH 미터’로 측정한다.

[그림] 용액의 pH 값을 측정 중인 pH meter.
용액의 pH 값은 온도의 영향을 받기 때문에,
온도 센서(용액에 담겨있는 왼쪽 기구)로 용액의 온도를 측정해서
pH 값을 보정한다.
( 참고: pH 미터 보정 방법 https://ywpop.tistory.com/12547 )
▶ 수산화 이온 농도도 수소 이온 농도와 같이 나타낼 수 있다.

pOH = –log[OH^-]
▶ 물의 이온곱 상수(Kw) 까지도...
( 참고: Kw https://ywpop.tistory.com/2704 )

Kw = [H^+][OH^-] = 1.0×10^(-14)
이 식의 양변에 –log를 곱하면,

pKw = pH + pOH = 14.00

▶ [수소 이온의 몰농도 ↔ 수산화 이온의 몰농도] 상호변환
[H^+][OH^-] = 1.0×10^(-14) 이므로,
[H^+] = (1.0×10^(-14)) / [OH^-]
[OH^-] = (1.0×10^(-14)) / [H^+]
---------------------------------------------------
용액의 pH가 7보다 높으면, 즉 염기성 용액이면,
용액에 존재하는 이온의 농도는 [H^+] < [OH^-] 이므로,
수산화 이온(OH^-)의 농도는 다음과 같이 구한다.
예를 들어, 용액의 pH가 12라면,
pH + pOH = 14 이므로,
pOH = 14 – pH = 14 – 12 = 2
pOH = –log[OH^-] = 2 이므로,
[OH^-] = 10^(-2) M
[참고] pH 8 용액의 [H^+]
pH = –log[H^+] = 8 이므로,
[H^+] = 10^(-8) M
[참고] pH 10 용액의 [H^+]
pH = –log[H^+] = 10 이므로,
[H^+] = 10^(-10) M
---------------------------------------------------
▶ 산 수용액의 pH 계산
예) 0.05 M HCl 용액의 pH
HCl(aq) → H^+(aq) + Cl^-(aq)
HCl : H^+ = 1 : 1 계수비 이므로,
[HCl] = [H^+] = 0.05 M
pH = –log[H^+] = –log(0.05) = 1.3
▶ 염기 수용액의 pH 계산
예) 0.05 M NaOH 용액의 pH
NaOH(aq) → Na^+(aq) + OH^-(aq)
NaOH : OH^- = 1 : 1 계수비 이므로,
[NaOH] = [OH^-] = 0.05 M
pOH = –log[OH^-] = –log(0.05) = 1.3
pH = 14 – pOH = 14 – 1.3 = 12.7
또는 한 번에 계산하면,
pH = 14 – pOH = 14 – (–log(0.05)) = 12.7
[참고] [H^+]가 10배 증가하면, pH는 1 감소한다.
[H^+] = 0.001 M ---> pH = –log(0.001) = 3
[H^+] = 0.010 M ---> pH = –log(0.010) = 2
[H^+] = 0.100 M ---> pH = –log(0.100) = 1
[참고]
진한 강산의 수용액을 강산성 용액,
진한 강염기의 수용액을 강알칼리성 용액이라 설명하지만,
pH 범위로 강산성 용액과 강알칼리성 용액을 분류하지는 않는다.
즉, 공식적으로(정의상),
pH 얼마 이하는 강산성이다. 또는,
pH 얼마 이상은 강알칼리성이다. 라는 기준은 없다.
일부 자료에서,
pH 3 이하는 강산성, pH 11 이상은 강알칼리로 분류해 놓은 것은
그 저자가 이해를 돕기 위해 자의적으로 설명한 것일 뿐이다.
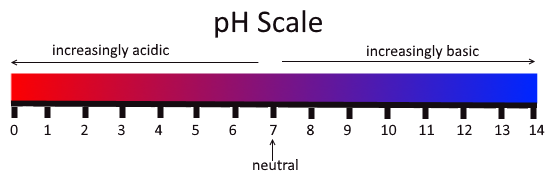
[ 그림 출처 commons.wikimedia.org ] pH 척도.
중성인 pH 7을 기준으로,
pH 0쪽으로 가면 산도(산성)가 증가하고,
pH 14쪽으로 가면 알칼리도(염기성)가 증가한다고만 설명되어있다.
[ 관련 글 https://ywpop.tistory.com/19911 ] 왜 pH 값이 작을수록 더 산성인가?
[ 관련 글 https://ywpop.tistory.com/9515 ] pH scale. pH 척도
[ 관련 글 https://ywpop.tistory.com/9983 ] pH 값은 음수이거나 14보다 높을 수 있나?

[ 관련 글 https://ywpop.tistory.com/10568 ] pOH 척도 대신 왜 pH 척도를 사용하나요?
[ 관련 글 https://ywpop.tistory.com/14450 ] 혼합 용액의 pH 계산
[ 참고 https://ywpop.tistory.com/6623 ] log 함수 계산
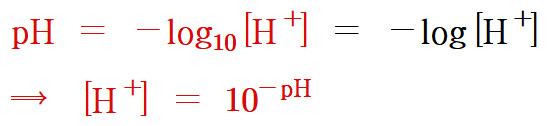
[키워드] pH의 정의 기준, pH 정의 기준, 페하 기준, 산도 기준, pH의 정의 사전, pH 정의 사전, 페하 사전, 산도 사전
'일반화학 > [16장] 산-염기 평형' 카테고리의 다른 글
| 크기가 작고 전하가 큰 금속 양이온과 물의 가수분해 반응 (1) | 2014.12.05 |
|---|---|
| 약산의 초기 농도와 Ka로부터 pH 구하기 예제 (6) | 2014.11.13 |
| 약산 ascorbic acid 용액의 pH. 250 mg / 250 mL (10) | 2014.11.03 |
| 약산의 Ka와 짝염기의 Kb 사이의 관계식, conjugate acid-base pairs ★ (1) | 2014.10.30 |
| pH 11.17인 NH3 용액의 몰농도 (0) | 2014.10.16 |
| 물의 자동이온화와 이온곱 상수, Kw ★ (4) | 2014.07.24 |
| 양쪽성양성자성(amphiprotic) 물질 ★ (2) | 2014.07.24 |
| 짝산, 짝염기, 짝 산-염기 쌍(conjugate acid-base pair) ★ (1) | 2014.07.23 |
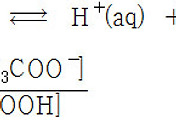

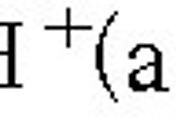
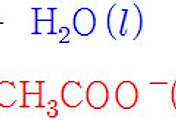
댓글