산과 염기의 정의. definition of acid and base
A. 아레니우스(Arrhenius)의 정의 (초급 수준)
B. 브뢴스테드-로우리(Brønsted-Lowry)의 정의 (중급 수준)
C. 루이스(Lewis)의 정의 (고급 수준)
---------------------------------------------------
▶ 참고: 제4장 수용액 반응. 목차
[ https://ywpop.tistory.com/15191 ]
▶ 참고: 제16장 산-염기 평형. 목차
[ https://ywpop.tistory.com/15336 ]
---------------------------------------------------
A. 아레니우스(Arrhenius)의 정의
▶ 아레니우스 산: 물에서 H^+ 이온을 내놓는 물질
▶ 아레니우스 염기: 물에서 OH^- 이온을 내놓는 물질
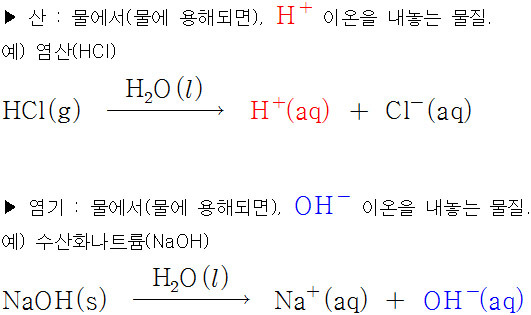
예) 아레니우스 산-염기 중화 반응
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
[참고] 강산과 강염기가 아레니우스 산-염기에 해당된다.
( 참고: 강산 강염기 https://ywpop.tistory.com/7421 )
---> 아레니우스 산-염기는
화학식에 H (H^+) 또는 OH (OH^-)를 포함하고 있다.
※ 지금부터는
NaOH와 같이, “화학식에 OH가 존재하는 물질만 염기”라는 생각은 버려라.
B. 브뢴스테드-로우리(Brønsted-Lowry)의 정의
▶ 브뢴스테드 산: H^+ 이온을 주는 물질 = 양성자 주게 산
▶ 브뢴스테드 염기: H^+ 이온을 받는 물질 = 양성자 받게 염기

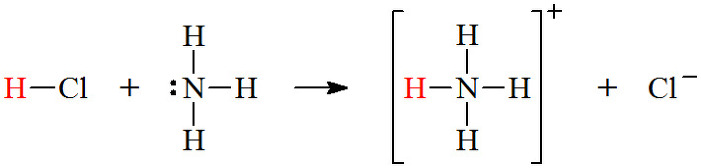
예3) 양성자 주게 산(H2O)과 양성자 받게 염기(NH3)의 반응
H2O(l) + NH3(aq) → NH4^+(aq) + OH^-(aq)
[주의] OH^-가 생성되었다고 해서,
NH3가 아레니우스 염기일거라 착각하지 말자.
NH3는 H2O로부터 양성자를 받는 브뢴스테드 염기이다.
[참고] NH3를 아레니우스 염기로 분류하는 자료도 있다.
[ https://terms.naver.com/entry.naver?cid=62802&docId=6556395&categoryId=62802 ]
---> 아무리 대한화학회 자료라 하더라도,
22/12/10 현재, 필자는 위 내용을 받아들일 수 없다.
---> 수능을 준비하는 고등학생은 학교 화학 선생님께 질문해서,
NH3가 아레니우스 염기 인지/아닌지를 반드시 확인할 것.
[ 관련 글 https://ywpop.tistory.com/22802 ] 아직까지는
NH3는 아레니우스 염기가 아니다라는 자료가 더 많다.
예) 트리메틸아민의 산-염기 중화 반응
(CH3)3N(aq) + HCl(aq) → (CH3)3NH^+(aq) + Cl^-(aq)
(CH3)3N: + H^+ → (CH3)3NH^+
R3N: + H^+ → R3NH^+
( 참고: 아민 https://ywpop.tistory.com/10625 )

( R–은 CH3–, CH3CH2– 등 알킬기. 또한 R–은 H–가 될 수도 있다. )
( 참고: 알킬기 https://ywpop.tistory.com/6274 )
모든 브뢴스테드-로우리 산은 루이스 산이다.
단, 모든 루이스 산은 브뢴스테드-로우리 산이 아니다.
All Brønsted-Lowry acids are Lewis acids, but the reverse is not true.
All Brønsted-Lowry bases are Lewis base
but all Lewis bases are not Bronsted-Lowry base.
모든 아레니우스 산은 브뢴스테드-로우리 산이며,
모든 브뢴스테드-로우리 산은 루이스 산이다.
Just as any Arrhenius acid is also a Brønsted acid,
any Brønsted acid is also a Lewis acid.
( 참고: HCl은 루이스 산 https://ywpop.tistory.com/4518 )
모든 아레니우스 산은 브뢴스테드-로우리 산이 될 수 있으나,
모든 아레니우스 염기는 브뢴스테드-로우리 염기가 될 수 없다.
NaOH와 같은 강염기는 브뢴스테드-로우리 염기가 아니다.
( 참고 https://ywpop.blogspot.com/2023/11/naoh.html )
All Arrhenius acids and bases are Brønsted-Lowry acids and bases as well.
But not all Brønsted-Lowry acids and bases are Arrhenius acids and bases.
[ 관련 글 https://ywpop.tistory.com/2700 ] 짝산 짝염기
C. 루이스(Lewis)의 정의
▶ 루이스 산: 전자쌍을 받는 물질 = 전자쌍 받게 산
▶ 루이스 산은 (전자쌍을 받을 수 있는) 비어있는 오비탈을 갖고 있다.
( 단, 필수 조건은 아님 https://ywpop.tistory.com/4518 )
▶ 루이스 염기: 전자쌍을 주는 물질 = 전자쌍 주게 염기
▶ 루이스 염기는 비공유 전자쌍을 갖고 있다.

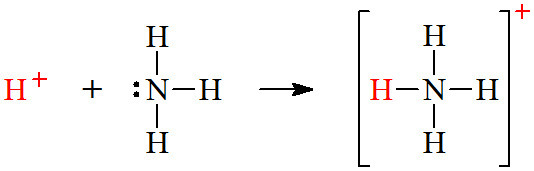

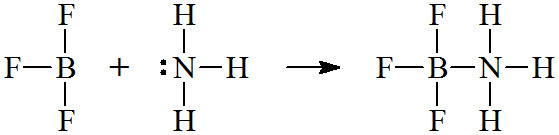
( 참고: 배위공유결합 https://ywpop.tistory.com/6023 )
아레니우스 산-염기는 산과 염기가 각각 따로 정의되지만,
브뢴스테드-로우리와 루이스 산-염기는
산과 염기가 한 짝으로 동시에 정의된다.
즉, 브뢴스테드-로우리 산이 있으면,
반드시 브뢴스테드-로우리 염기가 있어야 된다는 것이다.

[ 관련 글 https://ywpop.tistory.com/7421 ] 강산과 약산. 강염기와 약염기
[키워드] 산-염기의 정의 기준문서, 산-염기 정의 기준문서, 산과 염기 기준문서, 산 염기 기준문서, 산과 염기의 정의 기준문서, NH3 + H^+ → NH4^+, NH4^+ 그림, 산-염기의 정의 사전, 산-염기 정의 사전, 산과 염기 사전, 산 염기 사전, 산과 염기의 정의 사전, NH3-BF3 결합 기준, BF3-NH3 결합 기준
'일반화학 > [04장] 수용액 반응' 카테고리의 다른 글
| 이온결합 화합물의 용해도 지침, solubility guidelines (1) | 2014.11.02 |
|---|---|
| 0.10 M HNO3 500 mL + 0.10 M Ca(OH)2 500 mL 혼합 용액의 pH (0) | 2014.10.18 |
| 용액의 묽힘(희석, dilution) 법칙(원리) ★ (10) | 2014.10.07 |
| 산화수 구하는 규칙(rule) ★★ (14) | 2014.07.30 |
| 용액의 농도(concentration) 표시법 ★ (2) | 2014.07.03 |
| 분자 반응식, 이온 반응식, 알짜 이온 반응식 ★ (2) | 2014.04.30 |
| 부피 분석법과 적정 (0) | 2012.06.30 |
| 용액론. melt vs. dissolve (0) | 2012.06.22 |




댓글