공통이온효과. 포화 NaCl 용액 + HCl
포화 염화소듐(NaCl) 용액에 진한 염산(HCl)을 가하면 어떤 현상이 생기나요?
---------------------------------------------------
▶ 참고: 공통 이온 효과
[ https://ywpop.tistory.com/2710 ]
---------------------------------------------------
일반적으로 공통 이온 효과는 난용성염에 주로 적용되나,
( 관련 예제 https://ywpop.tistory.com/3141 )
중/고등 과정에서는 눈으로 쉽게 관찰할 수 있는
포화 염화나트륨 용액으로 실험합니다.
염화나트륨은 물에 아주 잘 용해되는 가용성염이므로,
포화용액 이전에서는 평형이 형성되지 않습니다.
NaCl(s) + H2O(l) → Na^+(aq) + Cl^-(aq) ... (1)
평형이 형성되는 포화용액을 만든 다음,
NaCl(s) + H2O(l) ⇌ Na^+(aq) + Cl^-(aq) ... (2)
여기에 공통 이온인 Cl^- 이온을 내놓는 진한 HCl 수용액을 가하면,
HCl(aq) → H^+(aq) + Cl^-(aq) ... (3)
공통 이온 효과에 의해 역반응이 진행되어, (2번 반응의 역반응)
그 결과 고체 NaCl이 석출됩니다.
NaCl(s) + H2O(l) ← Na^+(aq) + Cl^-(aq) ... (4)
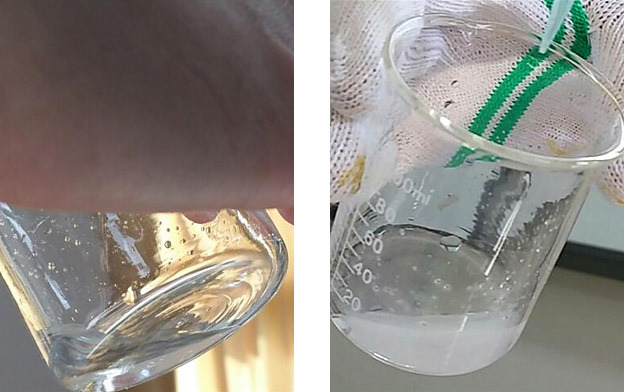
[왼쪽 그림] 포화 NaCl 수용액.
[오른쪽 그림] 진한 염산을 가했을 때.
흰색 NaCl이 석출되는 것을 확인할 수 있다.
[키워드] 공통 이온 효과 기준문서, 공통 이온 효과 실험, 공통 이온인 Cl^- 첨가, NaCl 재결정 실험
'화학' 카테고리의 다른 글
| 95% 알코올 시약으로 70% 용액 만들기 (0) | 2017.05.18 |
|---|---|
| 평형상수 계산. A2(g) + B2(g) → 2AB(g) (0) | 2017.05.18 |
| 4-acetoxy-3-(sec-butyl)benzoic acid (0) | 2017.05.17 |
| 나일론 66 합성. Making Nylon 66 (0) | 2017.05.17 |
| 열용량과 비열. 15.0 g of ice at 0°C and 200. mL of water at 25°C (0) | 2017.05.17 |
| 기체의 밀도와 분자량. 25℃, 1.2 atm의 NH3 밀도 (0) | 2017.05.16 |
| 완충용액의 pH. CH3COOH + NaOH (0) | 2017.05.16 |
| H2S + H2O 반응 (1) | 2017.05.16 |


댓글