728x170
기준 원자량의 변경. 탄소 대신 수소일 경우
현재 사용되는 원소의 원자량은 기준 A에 따른 것으로 12-C에 대한 상대적 질량이다.
기준 B는 12-C 대신 1-H를 사용하여 새로 제한된 것이다.
|
원자량을 정하는 기준 |
기준 A |
기준 B |
|
12-C의 원자량 = 12 |
1-H의 원자량 = 1 | |
|
1몰의 정의 |
12-C 12 g의 원자 수 |
1-H 1 g의 원자 수 |
|
기준에 따른 1-H의 원자량 |
1.008 |
1.000 |
다음 중 옳은 설명은?
1) 1몰의 원자 수는 기준 A보다 기준 B가 작다.
2) 탄소 12.000 g 을 완전 연소시키면 생성된 CO2 분자 수는
기준 A와 기준 B가 같다.
3) 탄소 12.000 g에 들어있는 12-C 원자 수는
수소 1.000 g에 들어있는 1-H 원자 수와 같다.
---------------------------------------------------------
답: 1), 2)
1) 탄소를 기준으로 하면, 수소 1몰은 1.008 g이고,
수소를 기준으로 하면, 수소 1몰은 1.000 g입니다.
따라서 1.008 g에 있는 원자 수는 1.000 g에 있는 원자 수보다 많습니다.
원자 수 역시 기준에 따른 상대값입니다.
2) 12.000 g은 절대값이기 때문에 기준 A, B 둘 다 같은 양이 나옵니다.
3) 가령 기준 A일 경우, 탄소 1몰 = 12.000 g이고, 수소 1몰 = 1.008 g이므로,
틀린 설명입니다.
반응형
그리드형(광고전용)
'화학' 카테고리의 다른 글
| 35% 염산(HCl) 용액으로 2% 염산 용액 200 mL 만드는 방법 (0) | 2015.11.12 |
|---|---|
| 2 M 암모니아수 50 mL 만드는 방법 (2) | 2015.11.12 |
| 산-염기 정의, 종류, 구분과 관련된 문제 (3) | 2015.11.11 |
| 약산-약염기의 염 용액의 pH. 0.200 M NH4F 용액의 pH (0) | 2015.11.11 |
| 산의 세기 비교. HI H2Te (1) | 2015.11.11 |
| 산화-환원 반응 완성하기: IO3- + I- → I3- (0) | 2015.11.10 |
| mmol/kg to mg/g, mg/g to mmol/kg (1) | 2015.11.10 |
| 원소와 화합물에서 각 원자의 산화수 구하기 (1) | 2015.11.10 |
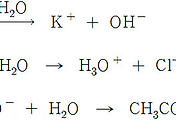
댓글