몰과 몰질량의 개념. 개미와 코끼리
수소 원자량이 1, 탄소 원자량이 12, 산소 원자량이 16 인데,
여기에 g을 붙이면 원자 1몰의 질량이라고 합니다.
그럼
수소 원자 1몰의 질량은 1 g,
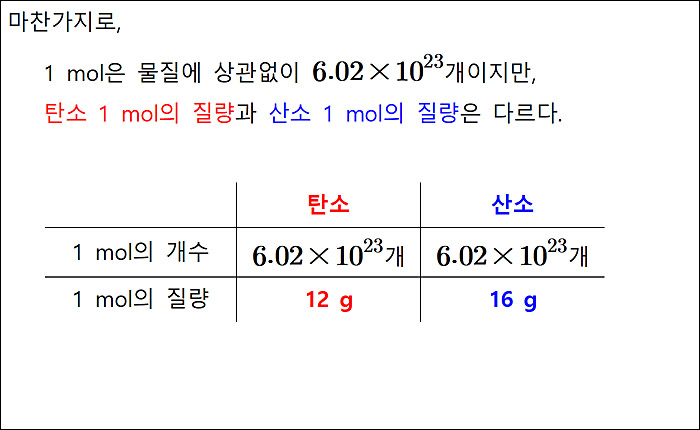
탄소 원자 1몰의 질량은 12 g,
산소 원자 1몰의 질량은 16 g 인데,
어떻게 질량이 다른데
개수가 6.02×10^23 개로 다 같을 수가 있는지 궁금합니다.
---------------------------------------------------
▶ 참고: 제3장 화학량론. 목차
[ https://ywpop.tistory.com/15189 ]
---------------------------------------------------
몰의 개념을 반대로 접근했기 때문에
발생한 궁금증인 것 같습니다.
일단, 몰이란 개념(정의) 자체는
너무나 간단하고 너무나 쉬운 개념(정의)입니다.^^
무지, 엄청, 매우, 단순하게도,
1몰 = 6.02×10^23 개
몰은 영어로 ‘mol’인데,
‘묶음’ 또는 ‘집합’으로 해석 가능합니다.
따라서 다음과 같이 나타낼 수 있습니다.
> 사람 1몰 = 사람 6.02×10^23 명
> 고양이 1몰 = 고양이 6.02×10^23 마리
> 야구공 1몰 = 야구공 6.02×10^23 개
> 자동차 1몰 = 자동차 6.02×10^23 대
이게 다, 전부, 끝 입니다.
지금부터는 이것 하나만 확실히 기억하면 됩니다.
물질 1몰 = 물질 6.02×10^23 개
그럼
수소 원자 1몰의 질량은 1 g,
탄소 원자 1몰의 질량은 12 g,
산소 원자 1몰의 질량은 16 g 인데,
어떻게 개수가 같은데 질량이 다 다를까요?
다시 말해,
수소 원자 6.02×10^23 개의 질량은 1 g,
탄소 원자 6.02×10^23 개의 질량은 12 g,
산소 원자 6.02×10^23 개의 질량은 16 g 인데,
어떻게 개수가 같은데 질량이 다 다를까요?
( 이렇게 접근해야 됩니다.^^ )
다시 한 번 더 묻겠습니다.
1몰이 무엇이라고요?
예, 6.02×10^23 개입니다.
여기서 생뚱맞은 질문 하나 하겠습니다.^^
잠실 야구장에 개미가 1몰 만큼 있다면,
개미는 몇 마리 있을까요?
예, 6.02×10^23 마리 있습니다.
그럼,
상암동 축구장에 코끼리가 1몰 만큼 있다면,
코끼리는 몇 마리 있을까요?
예, 6.02×10^23 마리 있습니다.
1몰이면, 그게 개미든, 코끼리든, 상관없이
6.02×10^23 마리가 있는 것입니다.
왜냐하면 몰의 정의에 따라,
6.02×10^23 마리가 1몰이니까요.
그렇지만,
개미 1마리의 무게와
코끼리 1마리의 무게는 다릅니다.
( 설마 왜 다르냐고 질문하지는 않겠지요.^^ )
이처럼 물질(원자)의 종류가 다르면,
당연히 물질(원자)의 질량도 다릅니다.

보너스 설명입니다.^^
탄소 원자 1몰의 질량이
왜 12 g인지를 설명하겠습니다.
19세기의 과학자들도
“물질(원자)이 다르면, 질량도 다르다.”
는 것쯤은 알고 있었습니다.
서로 다른 원자의 질량을 어떻게 나타내면 좋을까 고민하다가,
국제협약을 통해 탄소 원자 1개의 질량을
12 amu (atomic mass unit) 라고 기준으로 정했습니다.
그런 다음, 나머지 원자의 질량은 실험을 통해
탄소 원자의 상대적인 질량 비로 결정하였습니다.
즉, 탄소를 제외한 나머지 원자들의 질량은
탄소 원자량에 대한 상대 질량입니다.
예를 들어, 수소는 탄소 질량(12 amu)의
약 8.4%쯤 된다는 것을 실험을 통해 알아낸 다음,
수소 원자의 질량을 1.008 amu라고 결정한 것입니다.
12 amu × 0.084 = 1.008 amu
그런데 원자 1개는
너무나 작아서 눈으로 볼 수도 없고,
실험실에 있는 일반 전자저울로는
그 질량을 측정할 수도 없습니다.
그러나 원자 1개라도
물질이므로 엄연히 질량을 갖고 있습니다.
그렇다면, 원자 1개가 아니라,
원자 여러 개를 모아서 뭉쳐 놓으면,
눈에도 보이고, 일반 전자저울로도 질량을 측정할 수 있지 않을까요?
또 그렇다면, 도대체 원자 몇 개를 모아서 뭉쳐 놓으면 좋을까요?
한 번 더 생뚱맞은 이야기입니다.^^
지난번에 번개를 맞은 이후로
저에게는 신통방통한 능력이 하나 생겼습니다.
놀랍게도 핀셋으로 원자 하나하나를 집을 수 있게 되었습니다.
그래서 탄소 원자를 1개씩 핀셋으로 집어서
전자저울에 올려놓아 보았습니다.
계속해서 탄소 원자를 전자저울에 올려놓으니
전자저울의 눈금이 움직이기 시작했습니다.
탄소 원자 1개의 질량이 12 amu라서,
그냥 12 g이 될 때까지 탄소 원자를 올려놓아 보았습니다.
마침내 전자저울의 눈금에는 12 g이 표시되었고,
그때까지 올려놓은 탄소 원자의 개수를 헤아려보니
6.02×10^23 개 였습니다.
지금까지 이야기는 과학적으로 밝혀낸 사실을 생뚱맞게 설명한 것입니다.^^
( 참고: 아보가드로수와 몰 https://ywpop.tistory.com/6475 )
앞에서 원자의 질량은
탄소 원자량(amu로 나타낸)의 상대 질량이라고 했습니다.
즉,
탄소 원자 1개의 질량 = 12 amu 일 때,
수소 원자 1개의 질량 = 1 amu 입니다.
따라서
탄소 원자 10개의 질량이 120 amu 이면,
수소 원자 10개의 질량은 10 amu 가 되고,
탄소 원자 100개의 질량이 1200 amu 이면,
수소 원자 100개의 질량은 100 amu 가 됩니다.
| 탄소 원자 | 수소 원자 | |
| 1개 원자의 질량 비 | 12 | 1 |
| 10개 원자의 질량 비 | 10 × 12 | 10 × 1 |
| 100개 원자의 질량 비 | 100 × 12 | 100 × 1 |
| N개 원자의 질량 비 | N × 12 | N × 1 |
같은 원리로,
탄소 원자 6.02×10^23 개의 질량이 12 g 이면,
수소 원자 6.02×10^23 개의 질량은 1 g 이 됩니다.
정리하면,
탄소 원자 1몰 = 탄소 원자 6.02×10^23 개 = 탄소 원자 12 g
수소 원자 1몰 = 수소 원자 6.02×10^23 개 = 수소 원자 1 g
산소 원자 1몰 = 산소 원자 6.02×10^23 개 = 산소 원자 16 g
원자 또는 분자 하나하나는
너무나 작기 때문에 다루기 불편합니다.
그러나 몰의 개념을 사용하면,
즉, 6.02×10^23 개씩 묶어서 사용하면
이들을 쉽게 다룰 수 있습니다.
몰을 이해하는데 이 글이 도움 되었길 바랍니다.
[ 관련 글 https://ywpop.tistory.com/13548 ] 알기 쉬운 몰의 개념. 자동차의 바퀴와 핸들
[ 관련 글 https://ywpop.tistory.com/5397 ] 몰질량과 몰질량의 단위
[ 관련 글 https://ywpop.tistory.com/8321 ] 몰부피. 22.414 L/mol
[키워드] 몰의 정의 기준, 몰의 개념 기준, 몰의 정의 사전, 몰의 개념 사전, 개미와 코끼리 기준, 개미 기준, 개미와 코끼리 사전, 개미 사전
'일반화학 > [03장] 화학량론' 카테고리의 다른 글
| 화학량론적 계산 (0) | 2015.05.22 |
|---|---|
| 35℃ 746 mmHg CO2 1.46 L BaO CaO 4.88 g 252 mmHg (1) | 2015.05.19 |
| 산소 기체 8.0 g의 몰수, 분자수, 원자수, 부피 계산 (1) | 2015.05.15 |
| 화학 반응의 종류(유형). reaction types ★ (1) | 2015.04.30 |
| 한계반응물과 과잉반응물 계산(결정) ★ (4) | 2015.04.16 |
| CaCO3 열분해. 6.79 g CaO 생성될 때, CO2는 몇 g 생성 (2) | 2015.03.26 |
| 화학량론적 계산. Stoichiometric Calculations (0) | 2014.12.18 |
| 화학식과 질량 백분율(mass percentage). Morphine, Cocaine (2) | 2014.12.17 |



댓글