몰농도의 정의와 계산 방법
용액의 농도(concentration)란
“일정량의 용액(또는 용매)에 용해되어 있는 용질의 양”을 뜻합니다.
농도의 종류에는 질량 백분율, 몰분율, 몰농도, 몰랄농도 등이 있습니다.
( 참고 https://ywpop.tistory.com/2655 )
본 글에서는 ‘몰농도’만 알아보겠습니다.
▶ 몰농도(molarity, M)의 정의
> “용액 1 L에 용해되어 있는 용질의 몰수”
용액의 정의와 몰농도의 정의를 비교하면,
“일정량의 용액”은 “용액 1 L”,
“용질의 양”은 “용질의 몰수”와 대응합니다.
몰농도는 다음과 같이 나타낼 수도 있습니다.

몰농도 = 용질 mol수 / 용액 L수
여기서 주목해야 할 것은 (핵심 포인트)
어떤 용액의 몰농도를 계산할 때,
분모의 ‘1 L’에 신경 쓸 필요가 없다는 것입니다.
단지 용질의 몰수와 L단위로 나타낸 용액의 부피만 구해서,
[용질의 몰수 ÷ L단위로 나타낸 용액의 부피] 해주면 됩니다.
이것은 사각형의 면적을 계산하기 위해,
가로 길이와 세로 길이를 구해서,
[가로 길이 × 세로 길이] 해주는 것과 같은 이치입니다.
예로 들어,
NaOH 10 g을 증류수에 용해시켜 500 mL 용액을 만들었다.
이 용액의 몰농도를 계산하라는 문제가 있다면,
NaOH의 몰질량인 40 g/mol을 사용해서 용질인 NaOH의 몰수를 구하고,
용액의 부피인 500 mL를 L단위로 바꾼 다음,
[용질의 몰수 ÷ L단위로 나타낸 용액의 부피] 해주면 됩니다.
> 용질의 mol수 = 10 g / (40 g/mol) = 0.25 mol
( 참고: n=W/M https://ywpop.tistory.com/7738 )
> 용액의 L수 = 500 mL = 0.5 L
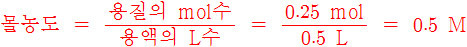
한 번에 계산하면,
몰농도
= 용질의 질량(g) / 용질의 몰질량(g/mol) / 용액의 부피(L)
= 10 g / (40 g/mol) / 0.5 L
= 0.5 mol/L
= 0.5 M
[예제] 63 g C6H12O6를 물에 녹여 만든 250 mL 용액의 몰농도(M)는?
단, C6H12O6의 몰질량 = 180 g/mol.
몰농도 = 63 g / (180 g/mol) / (250/1000 L)
= 1.4 mol/L
= 1.4 M
[예제] 10 mg/L HCl 용액의 몰농도는?
[ https://ywpop.tistory.com/23262 ]
[ 관련 글 https://ywpop.tistory.com/7787 ] 용액의 농도와 부피, 용질의 몰수 관계
[ 관련 글 http://ywpop.tistory.com/2667 ] 몰농도와 몰랄농도
[ 관련 글 https://ywpop.tistory.com/6131 ] 노르말농도 계산
[ 관련 글 https://ywpop.tistory.com/3093 ] 산-염기의 노르말농도
[키워드] 몰농도의 정의 기준문서, 몰농도 계산 기준문서, 몰농도의 정의 사전, 몰농도 계산 사전, 몰농도 경전
'화학 > 용액의 농도' 카테고리의 다른 글
| 40.0% 에틸렌 글리콜 수용액의 몰분율, 몰농도, 몰랄농도 (0) | 2015.06.16 |
|---|---|
| 33.33% 황산 용액(d 1.25)의 몰분율, 몰농도, 몰랄농도, 노르말농도 (0) | 2015.06.15 |
| 용액의 몰랄농도는 몰농도보다 크다 (1) | 2015.04.24 |
| 0.1050 M Na2CO3 17.5 mL 0.1250 M NaCl 46.0 mL (0) | 2015.04.20 |
| 37% 염산의 몰농도(M) (7) | 2015.03.10 |
| 퍼센트농도. w/w, v/v, w/v and v/w mean? ★ (0) | 2015.01.22 |
| 산-염기의 노르말농도(Normality, N) ★ (1) | 2014.12.18 |
| 물의 몰농도(M)는 55.6 M. Molarity of Water (1) | 2014.12.15 |


댓글