1.0 M NH3에서 AgCl의 몰용해도
착이온 Ag(NH3)2^+의 Kf는 1.7×10^7 이고,
AgCl의 Ksp는 1.6×10^(-10) 이다.
1.0 M NH3에서 AgCl의 몰용해도를 계산하여라.
The Kf for the complex ion Ag(NH3)2^+ is 1.7×10^7.
The Ksp for AgCl is 1.6×10^(-10).
Calculate molar solubility of AgCl in 1.0 M NH3.
---------------------------------------------------
.. AgCl(s) ⇌ Ag^+(aq) + Cl^-(aq) ... Ksp = 1.6e-10
+) Ag^+(aq) + 2NH3(aq) ⇌ Ag(NH3)2^+(aq) ... Kf = 1.7e+7
------------------------------------------------------------------
.. AgCl(s) + 2NH3(aq) ⇌ Ag(NH3)2^+(aq) + Cl^-(aq) ... Kc = ?
Kc = (1.6e-10) × (1.7e+7) = 0.00272
( 참고 https://ywpop.tistory.com/4154 )
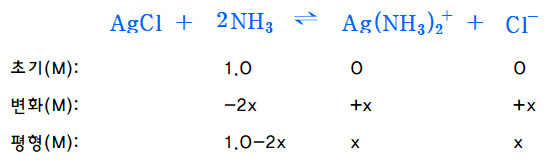
... AgCl(s) + 2NH3(aq) ⇌ Ag(NH3)2^+(aq) + Cl^-(aq)
평형에서 ..... 1.0–2x ......... x ............................ x
Kc = [Ag(NH3)2^+] [Cl^-] / [NH3]^2
= x^2 / (1.0–2x)^2 = 0.00272
(x / (1.0–2x))^2 = 0.00272
x / (1.0–2x) = (0.00272)^(1/2) = 0.0521536
x = 0.0521536 – 0.104307x
1.104307x = 0.0521536
x = 0.0521536 / 1.104307
= 0.047 M = [Cl^-] = [AgCl]
---> 1.0 M NH3에서 AgCl의 몰용해도
답: 0.047 M
[참고] 1.0 M NH3에서 AgCl의 몰용해도 = 0.047 M
1.0 M NH3 용액 1 L에 용해될 수 있는 AgCl의 몰수
= (0.047 mol/L) (1 L) = 0.047 mol
[ 관련 예제 https://ywpop.tistory.com/8210 ] 0.1 M NH3에서 AgCl의 몰용해도
[ 관련 예제 https://ywpop.tistory.com/8224 ] 1.0 M NH3에서 AgBr의 몰용해도
[키워드] AgCl의 몰용해도 기준, AgCl의 용해도 기준, AgCl의 Ksp 기준, Ag(NH3)2^+의 Kf 기준
'일반화학 > [17장] 수용액 평형의 다른 관점' 카테고리의 다른 글
| 용해도곱상수와 몰용해도. Ksp와 몰용해도 ★ (0) | 2018.01.14 |
|---|---|
| Ag3PO4의 Ksp 계산. 7.5×10^(-3) g/L ★ (0) | 2018.01.13 |
| 0.1 M NH4Cl 용액의 pH (0) | 2018.01.06 |
| 1.0 M NH3에서 AgBr의 몰용해도 (0) | 2017.12.12 |
| Ce(IO3)3의 몰용해도. 0.0450 M Ce^3+ + IO3^- (0) | 2017.12.07 |
| 아세트산 완충용액의 pH. 평형상수를 이용해 계산 (0) | 2017.12.03 |
| 0.115 M Mg^2+ 용액 2.55 L (1) | 2017.11.21 |
| 이온성 화합물 M2X3의 용해도곱 (0) | 2017.11.14 |


댓글