800 K I2(g) ⇌ 2I(g) Kc = 3.1×10^(-5) 10.0 L 2.67×10^(-2) g I(g)
800 K에서 I2(g) ⇌ 2I(g) 반응의 평형 상수 Kc = 3.1×10^(-5) 이다.
10.0 L 용기 안의 평형 혼합물에 2.67×10^(-2) g의 I(g)가 존재한다면,
I2(g)는 몇 g 존재할까?
At 800 K the equilibrium constant for I2(g) ⇌ 2I(g) is Kc = 3.1×10^(-5).
If an equilibrium mixture in a 10.0 L vessel contains
2.67×10^(-2) g of I(g), how many grams of I2(g) are in the mixture?
---------------------------------------------------
I의 몰질량 = 126.90 g/mol 이므로,
I(g)의 몰수
= (2.67×10^(-2) g) / (126.90 g/mol) = 0.0002104 mol
( 참고 https://ywpop.tistory.com/7738 )
I(g)의 몰농도
= 0.0002104 mol / 10.0 L = 2.104×10^(-5) M
( 참고 https://ywpop.tistory.com/7787 )
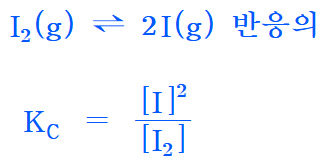
I2(g) ⇌ 2I(g) 반응의
Kc = [I]^2 / [I2]
[I2] = [I]^2 / Kc
= (2.104×10^(-5))^2 / (3.1×10^(-5))
= 1.428×10^(-5) M
(1.428×10^(-5) mol/L) × 10.0 L = 0.0001428 mol I2(g)
I2의 몰질량 = 253.81 g/mol 이므로,
0.0001428 mol × (253.81 g/mol) = 0.036244 g I2(g)
답: 3.62×10^(-2) g
[FAQ] [①22/10/24]
'일반화학 > [15장] 화학 평형' 카테고리의 다른 글
| 평형상수 K, 형성상수 Kf, 용해도곱상수 Ksp의 차이 (0) | 2015.12.02 |
|---|---|
| 평형상수, K의 의미 (0) | 2015.12.02 |
| 평형상수의 이론적 계산 ★ (0) | 2015.10.30 |
| 르샤틀리에 원리. 비활성기체와 평형 위치의 이동 (0) | 2015.10.28 |
| 순수한 액체와 고체의 농도가 평형 상수 표현에 포함되지 않는 이유 ★ (0) | 2015.07.14 |
| 평형상수. 아세트산에틸(ethyl ethanoate)의 제조 (3) | 2015.05.17 |
| 평형에서의 농도. 일산화탄소와 수소 혼합물(합성가스) (0) | 2015.05.14 |
| 르 샤틀리에(Le Chatelier)의 원리. 온도 변화 (1) | 2014.07.18 |


댓글