산화-환원 적정, redox titration
산을 염기로 적정하듯이, 산화제는 환원제로 적정한다.
예를 들어, 미지 시료가 산화제인 용액에 표준 용액인 환원제를 가하면, 당량점에서 산화제는 환원제에 의해 완전히 환원된다.
산-염기 적정처럼, 산화-환원 적정에서도 지시약이 필요하다.
산화-환원 지시약은 산화된 형태의 색과 환원된 형태의 색이 다르며, 당량점 부근에서 색이 변하기 때문에 당량점을 확인할 수 있다.
산화제로 많이 사용하는 중크롬산칼륨()과 과망간산칼륨(
)의 음이온은 다음과 같이 환원될 때 색이 변한다.
산화-환원 적정에서 이들 산화제는 산화/환원된 형태의 색이 다르므로, 내부 지시약으로 사용할 수 있다.
예제를 통해 산화-환원 적정에 대해 알아보자.
[예제] 산성 용액에서 용액 20 mL를 산화시키는데 0.13 M
용액 16.4 mL가 소비되었다.
용액의 농도는 얼마인가? 단, 알짜 이온 반응식은 다음과 같다.
------------------------------------------------------
산-염기 반응처럼, 산화-환원 반응도 균형 맞춘 반응식이 있어야 풀이가 가능하다.
( 없으면, 먼저 균형 맞춘 반응식을 완성해야 한다. )
문제에서 균형 맞춘 반응식이 주어졌기에 바로 풀이가 가능하다.
먼저 표준 용액인 의 농도와 부피로부터 반응한
의 몰수를 계산한다.
0.13 mol/L × 0.0164 L = 0.002132 mol
반응식을 보면, 의 몰수 비(계수 비)가 5 : 1이므로,
산화된 의 몰수를 계산하면,
0.002132 mol × 5 = 0.01066 mol
따라서 용액의 몰농도는
0.01066 mol / 0.020 L = 0.533 M 이 된다.
[ 관련 예제 http://ywpop.tistory.com/7381 ]
'화학' 카테고리의 다른 글
| How to Prepare 1 M Tris Buffer pH 8.0 (2) | 2014.10.27 |
|---|---|
| 혼합물의 질량백분율과 몰분율 (0) | 2014.10.27 |
| 몇 가지 앙금(침전) 생성 반응, precipitation reaction (0) | 2014.10.26 |
| 용액의 묽힘과 관련된 용액의 혼합비 (0) | 2014.10.25 |
| 질소 산화물, oxides of nitrogen (1) | 2014.10.23 |
| 원소의 질량 백분율, percentage by mass (0) | 2014.10.23 |
| pH 2 용액 10 mL와 pH 6 용액 1000 mL를 섞으면 pH는? (0) | 2014.10.23 |
| 100%가 아닌 액체 시약으로 용액 만들기 (0) | 2014.10.22 |



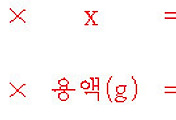

댓글