CH3Cl의 루이스 구조식. Lewis structure for CH3Cl
CH3Cl의 루이스 구조식. Lewis structure for CH3Cl
---------------------------------------------------
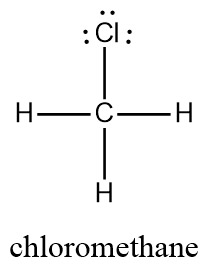
[그림] Lewis structure for chloromethane.
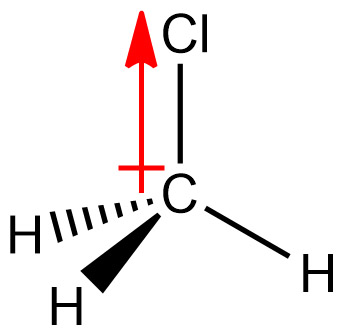
[그림] CH3Cl의 쌍극자 모멘트(dipole moment).
[참고]
CH3Cl has larger dipole moment than CH3F
because dipole moment is based on
the product of distance and charge.
▶ chloromethane의 bond angle
> 중심 원자의 전자 영역 = 4개 이므로,
CH3Cl 분자의 기본 기하 구조 = 정사면체.
( 참고 https://ywpop.tistory.com/2571 )
---> 기본 결합 각도 = 109.5°
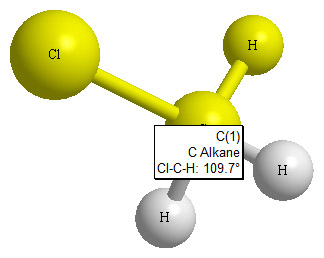

> Cl에 존재하는 비공유 전자쌍으로 인해,
∠Cl–C–H는 109.5°보다 크고,
∠H–C–H는 109.5°보다 작다.
[참고]
Cl은 H보다 전기음성도가 더 크기 때문에
중심 원자로부터 전자를 더 끌어당겨서
전자쌍 반발을 감소시키는 경향이 있으므로,
∠Cl–C–H는 109.5°보다 작은 108.5° 이고,
∠H–C–H는 109.5°보다 큰 110.5° 이다.
---> 이건 또 뭔 소리인가?
---> Cl의 비공유 전자쌍은 고려하지도 않고,
게다가 더 끌어당겨온 전자들은 도대체 어디에 존재한단 말인가?
---> 분명 Cl–C 결합 전자쌍 주변에 있을텐데,
이것들은 C–H 결합 전자쌍들과 반발하지 않는단 말인가?
---> 연구 대상
[키워드] CH3Cl 루이스 기준문서, CH3Cl 결합각 기준문서, CH3Cl 결합 각도 기준문서