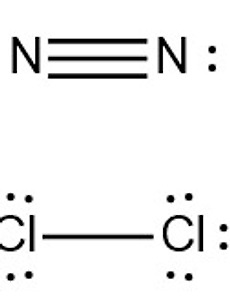 동핵 이원자 분자는 무극성
동핵 이원자 분자는 무극성 homonuclear diatomic molecule --------------------------------------------------- ▶ 동핵 이원자 분자 > 글자 그대로, 같은 종류의 2개 원자로 이루어진 분자. > 예: H2, N2, O2, F2, Cl2, Br2 ▶ 동핵 이원자 분자는 100%, 예외없이 전부 무극성 분자이다. [ 관련 예제 https://ywpop.tistory.com/20266 ] 다음 중 극성 분자에 해당하는 것 [키워드] 동핵 이원자 분자 기준문서, 동핵 2원자 분자 기준문서, 동핵 이원자 분자 사전, 동핵 2원자 분자 사전
2022. 10. 2.
동핵 이원자 분자는 무극성
동핵 이원자 분자는 무극성 homonuclear diatomic molecule --------------------------------------------------- ▶ 동핵 이원자 분자 > 글자 그대로, 같은 종류의 2개 원자로 이루어진 분자. > 예: H2, N2, O2, F2, Cl2, Br2 ▶ 동핵 이원자 분자는 100%, 예외없이 전부 무극성 분자이다. [ 관련 예제 https://ywpop.tistory.com/20266 ] 다음 중 극성 분자에 해당하는 것 [키워드] 동핵 이원자 분자 기준문서, 동핵 2원자 분자 기준문서, 동핵 이원자 분자 사전, 동핵 2원자 분자 사전
2022. 10. 2.