황산구리(II) 수용액과 아연판의 산화-환원
구리와 아연의 반응성을 알아보기 위해
황산구리(II) 수용액에 아연판을 넣었더니 아연판 표면에 구리가 석출되었다.
---------------------------------------------------
구리(Cu)는 전이금속이라서 다양한 산화수(=이온 전하)를 가진다.
( 참고 https://ywpop.tistory.com/7346 )
이 때문에 화합물 이름에 구리의 산화수를 함께 표시해준다.
‘황산구리(II)’에 표시된 괄호 안 ‘II’는 구리의 산화수(Cu^2+)를 의미한다.
( 참고 https://ywpop.tistory.com/3012 )
( 참고: CuSO4의 산화수 https://ywpop.tistory.com/9865 )

황산구리(II) 수용액: CuSO4(aq)
CuSO4의 이온화 반응식
CuSO4(aq) → Cu^2+(aq) + SO4^2-(aq)
아연판: Zn(s)
구리가 석출되었다: Cu^2+(aq) → Cu(s)
( 즉, 구리 이온이 구리 금속으로 환원되었다. )
산화-환원 반응은 동시에 일어난다.
구리가 환원되었으니, 뭔가가 산화되었을 것이다.
지문에는 안 나왔지만, 아연이 산화되었다.
Zn(s) → Zn^2+(aq)
( 참고: Cu 환원, Zn 산화 이유 https://ywpop.tistory.com/3195 )
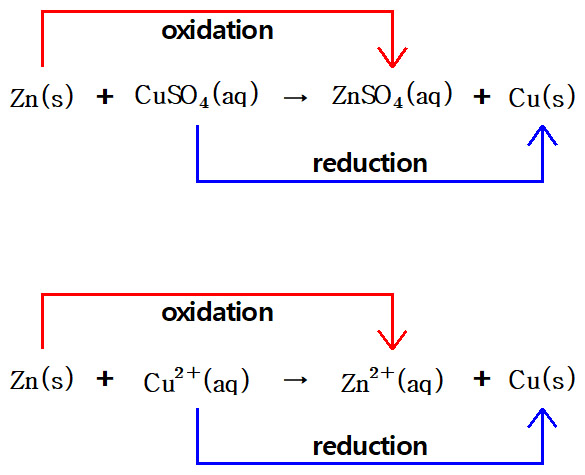
전체 산화-환원 반응
Zn(s) + Cu^2+(aq) → Zn^2+(aq) + Cu(s)
( 참고 https://ywpop.tistory.com/7923 )
산화 반쪽 반응: Zn(s) → Zn^2+(aq) + 2e^- (아연은 전자를 잃고, 산화됨.)
환원 반쪽 반응: Cu^2+(aq) + 2e^- → Cu(s) (구리는 전자를 얻어, 환원됨.)
Zn(s) + Cu^2+(aq) → Zn^2+(aq) + Cu(s)
수용액 속 아연 이온의 수는 증가하고,
수용액 속 구리 이온의 수는 감소한다.
---> 반응 전/후, 수용액 속 양이온의 수는 변하지 않는다.
---------------------------------------------------
Q. 구리 이온이 녹아있는 용액은 푸른색이다.
여기에 금속 아연을 넣으면 용액의 색깔은 어떻게 되는가?
A. 구리 이온의 색깔이 푸른색이므로,
구리 이온이 환원되면,
Cu^2+(aq) → Cu(s)
수용액 중 구리 이온의 농도가 감소하여
수용액의 푸른색은 점점 엷어진다.
( 나중에는 투명해진다. )
[키워드] redox Zn + Cu^2+, redox Cu^2+ + Zn, redox Zn + CuSO4, redox CuSO4 + Zn, 아연과 황산구리와 아연, 아연과 황산구리(II)와 아연, 구리와 아연의 반응성 기준문서, 아연과 구리의 반응성 기준문서, 황산구리(II) 수용액에 아연판 기준문서, 황산구리(II) 수용액에 아연 기준문서
'화학' 카테고리의 다른 글
| redox balance. NO3^- + I^- → NO + I2 (acidic) (1) | 2018.09.23 |
|---|---|
| Nessler 시약과 암모니아의 화학 반응식 (0) | 2018.09.22 |
| 등전자 계열 Ca^2+ Cs^+ Y^3+ (0) | 2018.09.22 |
| NaHCO3의 산화수 (0) | 2018.09.22 |
| 0.264 M H2O2 용액 250 mL에 들어있는 용질의 질량 (0) | 2018.09.22 |
| STP에서 1.34 L의 H2 기체가 O2와 완전 반응 (1) | 2018.09.21 |
| 극성 비극성 분자 찾기 예제 (0) | 2018.09.21 |
| 진동수를 파장으로. 3.64×10^7 Hz (0) | 2018.09.21 |
댓글