분자의 기하 구조와 원자가 껍질 전자쌍 반발 모형 (VSEPR model)
(1) 전자 영역 (Electron Domains)
---------------------------------------------------
▶ 참고: 제9장 분자의 기하학적 구조와 결합 이론. 목차
[ https://ywpop.tistory.com/15257 ]
---------------------------------------------------
복잡한 수식이나 이론 대신,
그냥 분자의 구조식, 예를 들면, 루이스(Lewis) 구조만 보고,
분자의 기하 구조를 예측할 수는 없 • 을 • 까?
↓
↓
↓
있다.
결합전자쌍 수와 비결합전자쌍 수를 보고,
분자의 기하 구조(3차원 모양)를 쉽게 예측할 수 있다.
“원자가 껍질 전자쌍 반발 모형” 이론만 알고 있으면...
원자가 껍질 전자쌍 반발 모형
Valence-Shell Electron-Pair Repulsion model (VSEPR model)
▶ 전자들은 서로 반발하기 때문에, 전자들은 가능한 한 서로 멀리 떨어지려고 한다.
→→→ 분자는 전자간 반발이 최소인 기하 구조를 갖는다.
※ 단, 결합에 참여하지 않는 핵심부 전자(core electrons)는 고려하지 않음.
분자의 루이스 구조를 보고,
분자의 기하 구조를 예측하기 위해서는,
우선 중심 원자의 전자 영역 개수를 셀 줄 알아야 한다.
( 전자 영역 = 입체수, steric number )
전자 영역 (Electron Domains)
( 의미: 전자들이 밀집해서 모여있는 공간 )
▶ 비결합전자쌍(Lone Pair) 1개 = 전자 영역 1개로 간주(count)
▶ 단일 결합 = 전자 영역 1개로 간주(count)
▶ 다중 결합 = 전자 영역 1개로 간주(count)
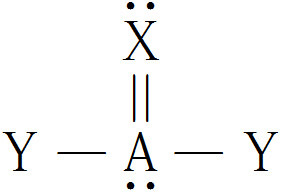
위 가상 분자에서, 중심 원자(A)의 전자 영역 개수는 4개이다.
( 비결합전자쌍 1개 + 단일결합 2개 + 이중결합 1개 = 4개 )
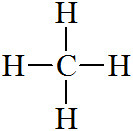
[예제 1] 메탄(methane)의 중심 원자, C의 전자 영역 = 4개
> 단일결합 4개 = 4개
[예제 2] 포름알데히드(formaldehyde)의 중심 원자, C의 전자 영역 = 3개
> 단일결합 2개 + 이중결합 1개 = 3개
( 참고: O의 전자 영역 = 3개 )
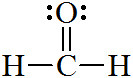
( Lp = lone pair. 비공유 전자쌍 )
[예제 3] 이산화탄소(carbon dioxide)의 중심 원자, C의 전자 영역 = 2개
> 이중결합 2개 = 2개
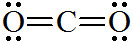
[예제 4] 시안화수소(hydrogen cyanide)의 중심 원자, C의 전자 영역 = 2개
> 단일결합 1개 + 삼중결합 1개 = 2개
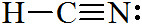
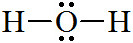
[문제] 물(water)의 중심 원자, O의 전자 영역은 몇 개인가?
↓
↓
↓
↓
↓
↓
↓
↓
답: 4개
> 단일결합 2개 + 비공유전자쌍 2개 = 4개
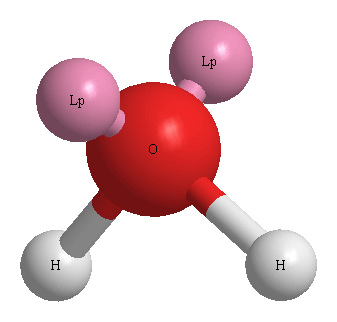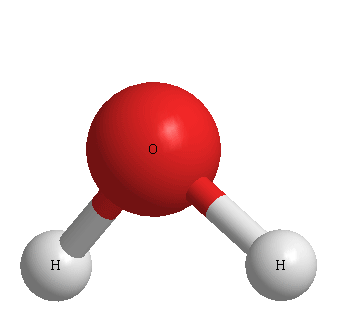
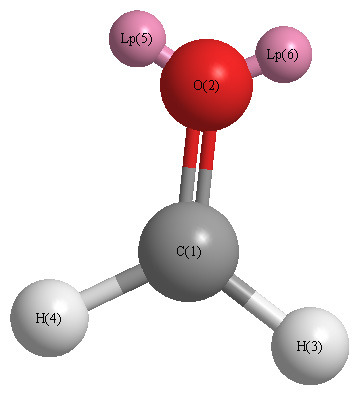
[그림] H2O의 3D 기하구조.
( Lp = lone pair. 비공유 전자쌍 )
[1개 동 = 1개 전자 영역]
1호, 2호, 3호, 4호, 이렇게,
4개 동으로 운영 중인 펜션이 있다.
각 동의 숙박 인원이 다음과 같다면,
1호 4명, 2호 6명, 3호 2명.
현재 사용 중인 동은 몇 개인가?
---> 3개
[ 이어지는 글 https://ywpop.tistory.com/2571 ] 중심원자의 전자영역 개수로 분자의 기하구조 예측
[ 관련 글 https://ywpop.tistory.com/7670 ] 큰 분자의 기하구조 예측. CH3-COOH의 기하구조
[ 관련 글 https://ywpop.tistory.com/11542 ] 중심원자의 혼성오비탈 결정 방법
[키워드] VSEPR 기준문서, 전자영역 기준문서, 입체수 기준문서, VSEPR dic, 전자영역 사전, 입체수 사전
'일반화학 > [09장] 분자의 기하구조와 결합 이론' 카테고리의 다른 글
| 혼성 오비탈 (hybrid orbital) ★ (9) | 2014.06.27 |
|---|---|
| 원자가 결합 이론. Valence Bond Theory, VBT (3) | 2014.06.27 |
| Sulfur Tetrafluoride(SF4) 분자의 Seesaw Molecular Geometry 설명 (0) | 2014.05.30 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (3) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (2) (0) | 2014.05.29 |
| 원자가 껍질 전자쌍 반발 모형으로 분자의 기하 구조 예측 (1) (2) | 2014.05.28 |
| 형식 전하와 루이스(Lewis) 구조. CO2의 루이스 구조 (5) | 2014.05.27 |
| ClF3 루이스 구조 그리기 (0) | 2014.05.18 |



댓글